题目内容
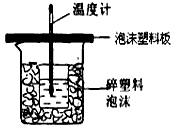
(2)烧杯间填满碎塑料泡沫的作用是______________________。
(3)大烧杯上如不盖泡沫塑料板,则求得的中和热数值_________(填“偏大”、“偏小'、“无影响”)
(4)实验中改用60mL 0.50mol·L-1的盐酸与50mL 0.55mol·L-1的NaOH溶液进行反应,与上述实验相比,所放出的热量______(填“相等”或“不相等”),理由是___________;所求中和热的数值会___________(填“相等”或“不相等”),理由是______________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会_______(填“偏大、“偏小”、“无影响”)。
(2)减少实验过程中的热量损失
(3)偏小
(4)不相等;因为酸、碱发生中和反应放出的热量与生成水的物质的量有关;相等;中和热是指强酸与强碱的稀溶液发生反应生成lmolH2O所放出的热量
(5)偏小

Ⅰ.(4分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品 是 。
(2)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
(3)如果反应前后的温度差是(t2-t1),盐酸、氢氧化钠溶液的密度均为1g/cm3,比热容为4.18J/(g•℃),写出该实验中和热的计算式:△H=
Ⅱ.(12分)影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol/L、2 mol/L、18.4 mol/L)。设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2 mol/L的硫酸于试管中 | 反应速率Mg>Fe,Cu不反应 | 金属的性质越活泼,反应速率越快 |
| ②___________________ |
(1)甲同学表中实验步骤②为____________________________________________。
(2)甲同学的实验目的是______________________________________;要得出正确的实验结论,还需控制的实验条件是________。
乙同学为了更精确的研究浓度对反应速率的影响,利用下图所示装置进行定量实验。
(3)乙同学在实验中应该测定的数据是______________。
(4)乙同学完成该实验应选用的实验药品是___________。
该实验中不选用某浓度的硫酸,理由是____________。
(共6分)实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:

|
实验次数 |
起始温度t1/℃ |
终止温度t2/℃ |
|
|
盐酸 |
NaOH溶液 |
||
|
1 |
20.2 |
20.3 |
23.7 |
|
2 |
20.3 |
20.5 |
23.8 |
|
3 |
21.5 |
21.6 |
24.9 |
完成下列问题:
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是 。
(2)在操作正确的前提下,提高中和热测定准确性的关键是 。
(3)根据上表中所测数据进行计算,则该实验测得的中和热ΔH= [盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将 (填“偏大”、“偏小”、 “不变”)。
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大