题目内容
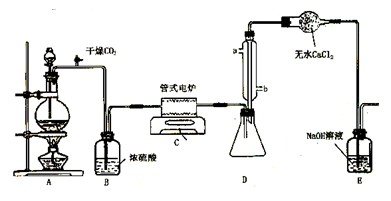
四氯化钛是无色液体,沸点为136℃.它极易水解,遇空气中水蒸气即产生“白烟”(TiCl4+H2O=TiOCl2+2HCl↑).四氯化钛可由TiO2与Cl2发生置换反应而制得(TiO2不与HCl反应).此反应在1000℃高温下进行得很慢,但如果有炭粉存在时,只要650℃~850℃反应便可顺利进行.下图是某同学设计的实验室制备TiCl4的装置图.

请回答:
(1)A装置中反应的化学方程式是________.
(2)B装置中的试剂为________,其作用是________.
(3)C装置中的反应方程式为________.
(4)D装置中冷凝水的方向为________进________出,该装置的作用为________.
(5)E装置中NaOH溶液的作用是________.
(6)请指出此装置的缺陷和不妥之处,并进行改进________.
解析:
|
(1)MnO2+4HCl(浓) (2)浓硫酸,吸收氯气中的水蒸气 (3)TiO2+2Cl2 (4)a,b,使TiCl4冷凝成液体流入锥形瓶中 (5)吸收氯气 (6)①E装置不能封闭,应在胶塞上加一根玻璃管使瓶内与大气相通;②在D、E之间缺少干燥装置,应在与冷凝管连接的导管处加一个装有碱石灰的干燥管,防止TiCl4水解 |

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
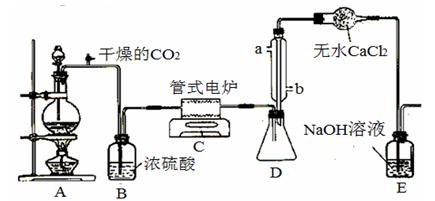
开心蛙口算题卡系列答案Ⅰ、 四氯化钛是无色液体,沸点为136℃。它极易水解,遇空气中水蒸气即产生“白烟”(TiCl4+H2O=TiOCl2+2HCl↑)。在650℃~850℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体。下图是某科研小组制备TiCl4的反应装置:
其主要操作步骤如下:
①连接好整套装置,在通Cl2前先通入CO2气体并持续一段时间;
②当锥形瓶中TiCl4的量不再增加时,停止加热,从侧管中改通CO2气体直到电炉中的瓷管冷却为止;
③将TiO2、炭粉混合均匀后,装入管式电炉中;
④将电炉升温到800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水。
试回答下列问题:
(1)正确的操作顺序为(填序号) ;
(2)装置A中的反应的离子方程式为 ;
(3)C装置中的反应的化学方程式为 。
Ⅱ、若该科研小组将刚吸收过少量SO2的NaOH溶液注入装置E对上述实验的尾气进行吸收处理,则吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl![]() 、CO32-、OH
、CO32-、OH![]() 和SO
和SO![]() 。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑盐类的水解).
。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑盐类的水解).
(1)提出合理假设:
假设1:只存在SO32-;
假设2:既不存在SO32-也不存在ClO-;
假设3: 。
(2)设计实验方案,进行实验。请写出实验步骤以及预期现象和结论。限选实验试剂:
a.3mo l![]() L-1 H2SO4 b.0.01mol
L-1 H2SO4 b.0.01mol![]() L-1 KMnO4 c.1mol
L-1 KMnO4 c.1mol![]() L-1 BaCl2
L-1 BaCl2
d.淀粉—KI溶液 e.酚酞试剂 f.品红溶液
| 实验步骤 |
|
| 步骤1:取少量吸收液于试管中,滴加3 mol | |
| 步骤2:向A试管中滴加1~2滴 (填序号)。 | 若溶液 ,则假设1成立。 否则,则假设2或3成立。 |
| 步骤3:向B试管中滴加1~2滴 (填序号)。 | 若溶液 ,则假设3成立。 否则,结合步骤2,则假设2成立。 |

 TiCl4+2CO
TiCl4+2CO 预期现象和结论
预期现象和结论