题目内容
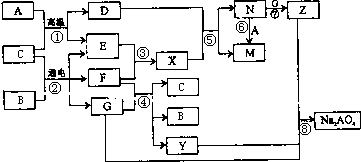
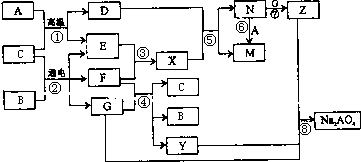
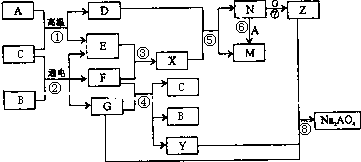
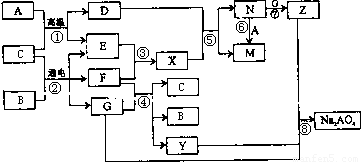
图是A~Z在一定条件下的转化关系(部分反应物或产物未列出).其中,A是生活中用途最为广泛的金属单质,常温下B是一种常见液体,E、F、X均为气体.物质Y和Na2AO4均有强氧化性,可用于杀菌消毒,Z是一种红褐色固体.

请回答下列问题:
(1)Y的电子式为
(2)在①?⑧中属于氧化还原反应,但又不是化合反应的是
(3)将Y和M混合后的现象是
(4)反应⑤的离子方程式是
(5)若在反应④中转移电子数为2NA,则消耗的F在标准状况下的体积是 L
(6)反应⑧的化学方程式是 .

请回答下列问题:
(1)Y的电子式为
(2)在①?⑧中属于氧化还原反应,但又不是化合反应的是
(3)将Y和M混合后的现象是
(4)反应⑤的离子方程式是
(5)若在反应④中转移电子数为2NA,则消耗的F在标准状况下的体积是
(6)反应⑧的化学方程式是
分析:A是生活中广泛使用的金属单质,常温下B是一种常见液体化合物,E、F、X均为气体.结合转化关系和反应条件,可以推断,A+B=D+E的反应是铁和水蒸气发生的反应;B+C通电电解得到E、F、G,E、F为气体,判断是电解食盐水的反应,B为H2O,C为NaCl,A为Fe,E为H2,F为Cl2,G为NaOH,D为Fe3O4;X为HCl,N为FeCl3,M为FeCl2,Z是一种红褐色固体,Z为Fe(OH)3;转化关系中的反应:F(Cl2)+G(NaOH)=C(H2O)+B(NaCl)+Y(NaClO);判断Y为NaClO,物质Y和Na2AO4均有强氧化性,可用于杀菌消毒,然后结合物质的性质及化学用语来解答.
解答:解:A是生活中广泛使用的金属单质,常温下B是一种常见液体化合物,E、F、X均为气体.结合转化关系和反应条件,可以推断,A+B=D+E的反应是铁和水蒸气发生的反应;B+C通电电解得到E、F、G,E、F为气体,判断是电解食盐水的反应,B为H2O,C为NaCl,A为Fe,E为H2,F为Cl2,G为NaOH,D为Fe3O4;X为HCl,N为FeCl3,M为FeCl2,Z是一种红褐色固体,Z为Fe(OH)3;转化关系中的反应:F(Cl2)+G(NaOH)=C(H2O)+B(NaCl)+Y(NaClO),可知Y为NaClO,
(1)Y为NaClO电子式为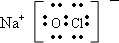 ,故答案为:
,故答案为: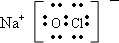 ;
;
(2)在①~⑧中属于氧化还原反应,但又不是化合反应的是,①是铁和水蒸气发生的置换反应,是氧化还原反应;②电解氯化钠是氧化还原反应,不是化合反应;③氢气和氯气反应生成氯化氢,是氧化还原反应,属于化合反应;④是氯气和氢氧化钠反应是氧化还原反应,不是化合反应;⑤是四氧化三铁和盐酸反应,不是氧化还原反应不是化合反应;⑥是氯化铁和铁反应生成氯化亚铁,是氧化还原反应,是化合反应;⑦氯化铁和氢氧化钠反应是复分解反应;⑧是氧化还原反应,不是化合反应;综上所述②④⑧符合,
故答案为;①②④⑧;
(3)M为FeCl2,Y为NaClO,Y和M混合发生氧化还原反应,生成铁离子及氢氧化铁沉淀,观察到溶液变为黄色,且有红褐色沉淀产生,
故答案为:溶液变为黄色,且有红褐色沉淀产生;
(4)反应⑤是四氧化三铁和盐酸反应,反应的离子方程式是Fe3O4+8H+=2Fe3++Fe2++4H2O,故答案为:Fe3O4+8H+=2Fe3++Fe2++4H2O;
(5)反应④是Cl2+2NaOH=NaCl+NaClO+H2O,则1molCl2反应,电子转移1mol,反应中转移电子数为2NA,则反应的氯气为2mol,则消耗的F(Cl2)在标准状况下的体积为44.8L,故答案为:44.8;
(6)反应⑧是氢氧化钠、氢氧化铁和次氯酸钠发生的反应生成Na2FeO4,铁元素化合价升高,氢氧化铁做还原剂,次氯酸钠做氧化剂被还原为氯离子,由原子守恒可知化学方程式为2Fe(OH)3+4NaOH+3NaClO=Na2FeO4+3NaCl+5H2O,故答案为:2Fe(OH)3+4NaOH+3NaClO=Na2FeO4+3NaCl+5H2O.
(1)Y为NaClO电子式为
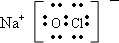 ,故答案为:
,故答案为: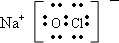 ;
;(2)在①~⑧中属于氧化还原反应,但又不是化合反应的是,①是铁和水蒸气发生的置换反应,是氧化还原反应;②电解氯化钠是氧化还原反应,不是化合反应;③氢气和氯气反应生成氯化氢,是氧化还原反应,属于化合反应;④是氯气和氢氧化钠反应是氧化还原反应,不是化合反应;⑤是四氧化三铁和盐酸反应,不是氧化还原反应不是化合反应;⑥是氯化铁和铁反应生成氯化亚铁,是氧化还原反应,是化合反应;⑦氯化铁和氢氧化钠反应是复分解反应;⑧是氧化还原反应,不是化合反应;综上所述②④⑧符合,
故答案为;①②④⑧;
(3)M为FeCl2,Y为NaClO,Y和M混合发生氧化还原反应,生成铁离子及氢氧化铁沉淀,观察到溶液变为黄色,且有红褐色沉淀产生,
故答案为:溶液变为黄色,且有红褐色沉淀产生;
(4)反应⑤是四氧化三铁和盐酸反应,反应的离子方程式是Fe3O4+8H+=2Fe3++Fe2++4H2O,故答案为:Fe3O4+8H+=2Fe3++Fe2++4H2O;
(5)反应④是Cl2+2NaOH=NaCl+NaClO+H2O,则1molCl2反应,电子转移1mol,反应中转移电子数为2NA,则反应的氯气为2mol,则消耗的F(Cl2)在标准状况下的体积为44.8L,故答案为:44.8;
(6)反应⑧是氢氧化钠、氢氧化铁和次氯酸钠发生的反应生成Na2FeO4,铁元素化合价升高,氢氧化铁做还原剂,次氯酸钠做氧化剂被还原为氯离子,由原子守恒可知化学方程式为2Fe(OH)3+4NaOH+3NaClO=Na2FeO4+3NaCl+5H2O,故答案为:2Fe(OH)3+4NaOH+3NaClO=Na2FeO4+3NaCl+5H2O.
点评:本题考查无机物的推断,侧重氯及其化合物、铁及其化合物性质的推断和性质的考查,物质的推断为解答的关键,B、Z的推断为解答本题的突破口,注意电子式、离子方程式、化学方程式的书写方法,题目难度中等.

练习册系列答案
相关题目