题目内容
【题目】下列说法正确的是( )
A.在共价化合物中不可能含有离子键
B.阴阳离子之间通过静电引力形成的化学键,叫离子键
C.含有共价键的化合物一定是共价化合物
D.含有离子键的化合物不一定是离子化合物
【答案】A
【解析】
A.含有离子键的化合物一定是离子化合物,所以共价化合物中不可能含有离子键,A正确;
B.离子键是由阴阳离子形成的,即阴阳离子之间通过静电作用(既有吸引也有排斥)形成离子键,B错误;
C.离子化合物中也可能含有共价键,如氢氧化钠属于离子化合物,既含有离子键又含有共价键,所以含有共价键的化合物不一定是共价化合物,C错误;
D.含有离子键的化合物一定是离子化合物,D错误;
答案选A。

 名校课堂系列答案
名校课堂系列答案【题目】低碳经济是以低能耗、低污染、低排放为基础的经济模式,低碳经济的概念在中国正迅速从高端概念演变成全社会的行为,在新能源汽车、工业节能等多个领域都大有作为.请运用化学反应原理的相关知识研究碳及其化合物的性质
(1)工业上可利用CO或CO2来制备燃料甲醇.
已知:800℃时,化学反应①、反应②对应的平衡常数分别为2.5、1.0
反应①:2H2(g)+CO(g)CH3OH(g)△H=-90.8kJmol-1
反应②:H2(g)+CO2(g)H2O(g)+CO(g)△H=+41.2kJmol-1
写出用CO2与H2反应制备甲醇的热化学方程式___________.
800℃时该反应的化学平衡常数K的数值为___________.
(2)现将不同量的CO2(g)和H2(g)分别通入到容积为2L的恒容密闭容器中发生反应: CO(g)+H2O(g)CO2(g)+H2(g)ΔH=+41.2KJ/mol,得到如下二组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
CO2(g) | H2(g) | H2O(g) | CO2(g) | |||
1 | 900 | 4 | 2 | 1.6 | 2.4 | 2 |
2 | 900 | a | b | c | d | t |
实验2中,若平衡时,CO2(g)的转化率小于H2(g).则a、b必须满足的关系是__________。
若在900℃时,另做一组实验,在此容器中加入10molCO2(g),5molH2,2molCO,5molH2O(g),则此时v正____v 逆(填“<”>“或“=”)。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:CH3OH(g)+CO(g) ![]() HCOOCH3(g) ΔH=-29.1 kJ·mol-1,科研人员对该反应进行了研究,部分研究结果:
HCOOCH3(g) ΔH=-29.1 kJ·mol-1,科研人员对该反应进行了研究,部分研究结果:

①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是________。 (填“3.5×106 Pa”、 “4.0×106 Pa”或““5.0×106 Pa”)。
②实际工业生产中采用的温度是80℃,其理由是_________________。
(4)常温下,向20.0mLcmol/L的氨水中滴加20mL.0.2mol/LHNO3溶液后,恰好使溶液显中性(设混合溶液总体积为两溶液体积之和)。计算常温下NH3·H2O![]() NH4++OH-的电离平衡常数K(NH3·H2O)=_________(用含c的式子表示)。
NH4++OH-的电离平衡常数K(NH3·H2O)=_________(用含c的式子表示)。
【题目】为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.
(1)滴定原理为:(用离子方程式表示).
(2)滴定时,KMnO4溶液应装在(填“酸式”或“碱式”)滴定管中,达到滴定终点时的现象为 .
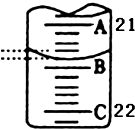
(3)如图表示50mL滴定管中液面的位置,此时滴定管中液面的读数为mL.
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 26.32 | 25.35 | 25.30 |
从上表可以看出,第一次实验中记录消耗KMnO4溶液的体积明显多于后两次,其原因可能是
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积.
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡.
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过,未用标准液润洗,后两次均用标准液润洗.
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗.
E.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定.
(5)根据所给数据,写出计算H2C2O4的物质的量浓度的表达式(不必化简):C=mol/L.