题目内容
16.下表是周期表中的一部分,根据A-I在周期表中的位置,用元素符号或化学式回答下列问题:| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)最高价氧化物的水化物碱性最强的碱是NaOH,酸性最强的酸是HClO4,呈两性的物质是Al(OH)3;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF;
(4)在B、C、D、E、F、G、H中,原子半径最大的是Na,最小的是F.
分析 由元素在周期表的位置可知,A-I分别为H、Na、Al、C、N、P、F、Cl、Ne,
(1)稀有气体的性质最稳定,F无正价;非金属性越强,单质的氧化物越强;金属性越强,对应单质的还原性越强;
(2)金属性越强,对应最高价氧化物的水化物碱性越强;非金属性越强,对应最高价氧化物的水化物酸性越强;氢氧化铝具有两性;
(3)非金属性越强,对应氢化物越稳定;
(4)电子层越多,原子半径越大,同周期从左向右原子半径减小.
解答 解:由元素在周期表的位置可知,A-I分别为H、Na、Al、C、N、P、F、Cl、Ne,
(1)表中元素,化学性质最不活泼的是Ne,只有负价而无正价的是F,氧化性最强的单质是F2,还原性最强的单质是Na,
故答案为:Ne;F;F2;Na;
(2)最高价氧化物的水化物碱性最强的碱是NaOH,酸性最强的酸是HClO4,呈两性的物质是Al(OH)3,
故答案为:NaOH;HClO4;Al(OH)3;
(3)上述元素中F的非金属性最强,A分别与D、E、F、G、H形成的化合物中,最稳定的HF,
故答案为:HF;
(4)电子层越多,原子半径越大,同周期从左向右原子半径减小,则在B、C、D、E、F、G、H中,原子半径最大的是Na,最小的是F,
故答案为:Na;F.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案
相关题目
4.下列有关物质结构的表述正确的是( )
| A. | 次氯酸的结构式:H-Cl-O | |
| B. | 二氧化硅的分子式:SiO2 | |
| C. | 硫原子的最外层电子排布式:3s23p4 | |
| D. | 钠离子的结构示意图: |
1.能用带磨砂玻璃塞的试剂瓶盛放的物质是( )
| A. | HF溶液 | B. | NaOH溶液 | C. | 盐酸 | D. | 水玻璃 |
5.己知在甲苯、苯甲醇组成的混合物中,氧元素的质量分数为8%,则氢元素的质量分数为( )
| A. | 7% | B. | 8% | C. | 8.2% | D. | 无法计算 |
17.现有部分短周期元素的性质或原子结构如表:
(1)X3Y、X2T、XZ都是离子化合物,这三种化合物中所涉及离子的半径由大到小的顺序是Cl->S2->N3->Na+(用离子符号表示).
(2)T与Z的氢化物的稳定性:HCl>H2S(填化学式),依据是Cl的非金属性大于S,则HCl的稳定性大于H2S.
(3)写出W的单质与X的最高价氧化物对应的水化物反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)Y的一种液态氢化物Y2H4具有强还原性,能与溴化银反应生成黑色银粒,本身被氧化成Y单质,写出发生反应的化学方程式:N2H4+4AgBr=4Ag+N2↑+4HBr,该反应中氧化产物的电子式为 .
.
| 元素 | 元素性质或原子结构 |
| T | 元素最高正价是+6 |
| X | 在短周期元素中原子半径最大 |
| Y | 氢化物与最高价氧化物对应的水化物反应生成盐 |
| Z | M层上有7个电子 |
| W | 其单质既能跟酸反应,又能跟碱反应,且都产生H2 |
(2)T与Z的氢化物的稳定性:HCl>H2S(填化学式),依据是Cl的非金属性大于S,则HCl的稳定性大于H2S.
(3)写出W的单质与X的最高价氧化物对应的水化物反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)Y的一种液态氢化物Y2H4具有强还原性,能与溴化银反应生成黑色银粒,本身被氧化成Y单质,写出发生反应的化学方程式:N2H4+4AgBr=4Ag+N2↑+4HBr,该反应中氧化产物的电子式为
 .
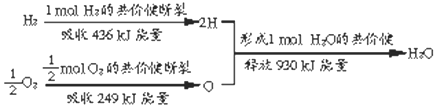
. 
 a、b、c、d、e、f是原子序数依次增大的6种短周期元素,a、d同主族,a是原子半径最小的元素,b的最高正化合价与最低负化合价的代数和为零,a与c、d与c均可形成原子个数之比为2:1和1:1的化合物,d、e的最外层电子数之和等于b的最外层电子数,f是同周期中得电子能力最强的元素.
a、b、c、d、e、f是原子序数依次增大的6种短周期元素,a、d同主族,a是原子半径最小的元素,b的最高正化合价与最低负化合价的代数和为零,a与c、d与c均可形成原子个数之比为2:1和1:1的化合物,d、e的最外层电子数之和等于b的最外层电子数,f是同周期中得电子能力最强的元素. .a、c、d三种元素形成的化合物中存在的化学键类型是离子键、共价键.
.a、c、d三种元素形成的化合物中存在的化学键类型是离子键、共价键.


