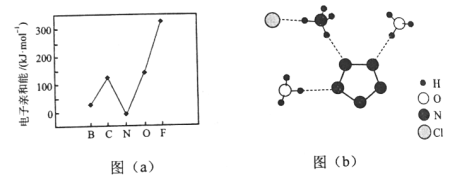
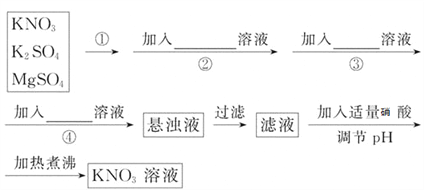
题目内容
【题目】《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在470℃、80![]() 下合成出金刚石,具有深远意义。下列说法不正确的是( )
下合成出金刚石,具有深远意义。下列说法不正确的是( )
A. 由二氧化碳合成金刚石是化学变化
B. 金刚石和石墨互为同位素
C. 钠被氧化最终生成碳酸钠
D. 金刚石属于原子晶体
【答案】B
【解析】A项,由二氧化碳合成金刚石有新物质生成,是化学变化,A正确;B项,同位素必须是核素,金刚石和石墨是碳元素的单质,B错误;C项,钠性质活泼,钠和氧气反应生成氧化钠,氧化钠和水反应生成氢氧化钠,氢氧化钠潮解后和二氧化碳反应生成碳酸钠晶体,再风化得到碳酸钠,所以钠被氧化最终生成碳酸钠,C正确;D项,金刚石是由C原子构成的空间网状结构,是原子晶体,D正确。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目