题目内容
已知0.1mol/L H2SO4在水中的第一步电离是完全的,第二步电离并不完全。常温下有0.1mol/L的以下几种溶液的电离度(即已经电离的分子数占原来分子总数的百分数)如下表,回答下列问题:
(1)写出H2SO4在水中的电离方程式 。
(2)常温下,题设条件下的①溶液中c(H+)= 。
(3)常温下,pH相同的上述几种溶液,其物质的量浓度由大到小的顺序是(填序号) 。
(4)若将10mL题设条件下的NaHSO4溶液与0.1mol/LNaOH溶液等体积混合,则混合后溶液中离子浓度由大到小顺序为 。
(5)根据题设条件计算CH3COOH的电离常数Ka= 。若常温下,将b mol·L–1的CH3COONa液与0.01 mol·L–1的盐酸等体积混合,反应达平衡时,测得溶液的pH=7,用含b的代数式表示CH3COOH的电离常数Ka= 。
| ①H2SO4溶液中的HSO4– | ②NaHSO4溶液中的HSO4– | ③CH3COOH | ④HCl溶液 |
| 10% | 29% | 1.33% | 100% |
(2)常温下,题设条件下的①溶液中c(H+)= 。
(3)常温下,pH相同的上述几种溶液,其物质的量浓度由大到小的顺序是(填序号) 。
(4)若将10mL题设条件下的NaHSO4溶液与0.1mol/LNaOH溶液等体积混合,则混合后溶液中离子浓度由大到小顺序为 。
(5)根据题设条件计算CH3COOH的电离常数Ka= 。若常温下,将b mol·L–1的CH3COONa液与0.01 mol·L–1的盐酸等体积混合,反应达平衡时,测得溶液的pH=7,用含b的代数式表示CH3COOH的电离常数Ka= 。
(1)H2SO4=HSO4–+H+ HSO4– H++ SO42– (2分) (2)0.11 mol·L–1(2分)
H++ SO42– (2分) (2)0.11 mol·L–1(2分)
(3)③②④①或③>②>④>① (2分)
(4)c(Na+)>c(SO42–)>c(OH–)>c(HSO4–)>c(H+) (2分)
(5)1.77×10–5或1.8×10–5 (2分)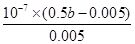 或(b-0.01)×10-5(2分)
或(b-0.01)×10-5(2分)
 H++ SO42– (2分) (2)0.11 mol·L–1(2分)
H++ SO42– (2分) (2)0.11 mol·L–1(2分)(3)③②④①或③>②>④>① (2分)
(4)c(Na+)>c(SO42–)>c(OH–)>c(HSO4–)>c(H+) (2分)
(5)1.77×10–5或1.8×10–5 (2分)
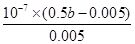 或(b-0.01)×10-5(2分)
或(b-0.01)×10-5(2分)试题分析:(1)已知0.1mol/L H2SO4在水中的第一步电离是完全的,第二步电离并不完全,所以硫酸在水中的电离方程式为H2SO4=HSO4–+H+ HSO4–
 H++ SO42–。
H++ SO42–。(2)H2SO4 = HSO4– + H+
0.1mol/L 0.1mol/L 0.1mol/L
HSO4–
 H++ SO42–
H++ SO42–0.1mol/L×10% 0.1mol/L×10%
所以溶液中氢离子浓度=0.1mol/L+0.1mol/L×10%=0.11mol/L
(3)硫酸是二元酸,第一步完全电离,第二步部分电离。盐酸是一元酸,完全电离。硫酸氢钠中HSO4-的电离程度强于醋酸的电离程度,所以常温下,pH相同的上述几种溶液,其物质的量浓度由大到小的顺序是③>②>④>①。
(4)将10mL题设条件下的NaHSO4溶液与0.1mol/LNaOH溶液等体积混合,二者恰好反应生成硫酸钠,但由于SO42-水解SO42-+H2O
 HSO4-+OH-,因此溶液显碱性。又因为水还电离出OH-,所以溶液中离子浓度大小顺序是c(Na+)>c(SO42–)>c(OH–)>c(HSO4–)>c(H+)。
HSO4-+OH-,因此溶液显碱性。又因为水还电离出OH-,所以溶液中离子浓度大小顺序是c(Na+)>c(SO42–)>c(OH–)>c(HSO4–)>c(H+)。(5)醋酸的电离度是1.33%,则
CH3COOH
 CH3COO- + H+
CH3COO- + H+起始浓度(mol/L) 0.1 0 0
转化浓度(mol/L) 0.1×1.33% 0.1×1.33% 0.1×1.33%
平衡浓度(mol/L)0.1-0.00133 0.00133 0.00133
所以该温度下醋酸的电离常数=
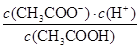 =
=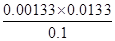 =1.77×10–5
=1.77×10–5反应达平衡时,测得溶液的pH=7,则根据电荷守恒可知c(CH3COO-)+c(Cl-)+c(OH–)=c(Na+)+c(H+),因此c(OH–)=c(H+)=10-7mol/L、c(CH3COO-)+c(Cl-)=c(Na+)=0.5bmol/L,所以c(CH3COO-)=c(Na+)-c(Cl-)=0.5bmol/L-0.005mol/L。根据物料守恒可知溶液醋酸的浓度是0.5bmol/L-(0.5bmol/L-0.005mol/L)=0.005mol/L,所以该温度下醋酸的电离常数=
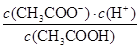 =
=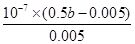 =(b-0.01)×10-5
=(b-0.01)×10-5
练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目
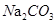 溶液通入
溶液通入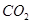 ,可使水解平衡:
,可使水解平衡: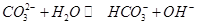 向正反应方向移动,则溶液pH增大
向正反应方向移动,则溶液pH增大  某一元酸HA在水中有0.1%发生电离,则该溶液的pH=4
某一元酸HA在水中有0.1%发生电离,则该溶液的pH=4 溶液中含有的
溶液中含有的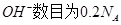
 H++HB-;HB-
H++HB-;HB- H++B2-;现有溶液 0.10mol/L、100ml,试回答以下问题:
H++B2-;现有溶液 0.10mol/L、100ml,试回答以下问题: