题目内容
氯气是一种重要的化工原料,在生产和生活中的应用十分广泛。
(1)请写出实验室用二氧化锰和浓盐酸共热制取氯气的化学方程式。
(2)实验室欲制得氯气1.12 L,理论上需要消耗二氧化锰多少克?
(3)①若用3.36 L 氯气与4.0 mol/L的NaOH溶液反应制取简易消毒液,则需要多少毫升这种NaOH溶液能与氯气恰好完全反应?
②实验发现,该反应产物的质量明显小于理论值,可能的原因是
。
(1)请写出实验室用二氧化锰和浓盐酸共热制取氯气的化学方程式。
(2)实验室欲制得氯气1.12 L,理论上需要消耗二氧化锰多少克?
(3)①若用3.36 L 氯气与4.0 mol/L的NaOH溶液反应制取简易消毒液,则需要多少毫升这种NaOH溶液能与氯气恰好完全反应?
②实验发现,该反应产物的质量明显小于理论值,可能的原因是
。
(1)MnO2+4HCl(浓)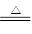 MnCl2+2H2O+Cl2↑(2分)
MnCl2+2H2O+Cl2↑(2分)
(2)4.35 g(3分)
(3)① 75 mL (3分)
② 通入氯气过快,未与氢氧化钠溶液充分反应(2分)(其他合理答案也给分)
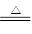 MnCl2+2H2O+Cl2↑(2分)
MnCl2+2H2O+Cl2↑(2分)(2)4.35 g(3分)
(3)① 75 mL (3分)
② 通入氯气过快,未与氢氧化钠溶液充分反应(2分)(其他合理答案也给分)
试题分析:(2)制得氯气1.12 L,n=V/Vm=0.05mol
MnO2+4HCl(浓)
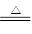 MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑1 1
X 0.05mol
X=0.05mol 二氧化锰质量m=M×n=0.05mol×87g/mol="4.35" g
(3) ①: Cl2+2NaOH=NaCl+NaClO+H2O
由反应可知:氯气和氢氧化钠的物质的量之比为1:2. n(Cl2)=V/Vm=0.15mol
n(NaOH)=2n(Cl2)=0.3mol。V=n/C=0.3mol/(4.0 mol/L)=0.075L=75ml
②:产物的质量明显小于理论值,说明二者没有充分反应,可能是通入氯气过快
点评:本题集合氯气的性质和制取,物质的量的简单计算,题目难度不大,但要能正确书写出化学方程式,并按照解析步骤逐步解答。

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目