题目内容
【题目】液体燃料电池相比于气体燃科电池具有体积小,无需气体存储装置等优点。一种以胼(N2H4)为燃料的电池装置如下图装置①,该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列有关叙述不正确的是
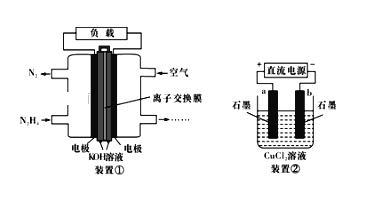
A. 该燃料电池负极发生的电极反应为:N2H4+4OH--4e-═N2↑+4H2O
B. 用该燃料电池作为装置②的直流电源,产生7.1gCl2至少需加入0.5molN2H4
C. 该燃料电池放电一段时间后,KOH溶液的pH保持不变(KOH溶液经充分搅拌且忽略反应过程中溶液体积的改变)
D. 该燃料电池的电极材料应采用多孔导电材料,其目的是提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触
【答案】B
【解析】A.通入燃料的电极为负极,N2H4在碱性介质中失电子发生氧化反应,电极反应式为:N2H4+4OH--4e-=N2↑+4H2O,故A正确;B.电解氯化铜生成氯气的电极反应式为2Cl--2e-=Cl2↑,生成1mol氯气转移2mol电子,现生成7.1g氯气转移0.2mol电子,因转移电子数是相等的,燃料电池中的负极反应为:N2H4+4OH--4e-=N2↑+4H2O,则转移0.2mol电子,消耗0.05mol的N2H4,故B错误;C.该电池的总反应为:N2H4 + O2 = N2+2H2O,因KOH溶液经充分搅拌且忽略反应过程中溶液体积的改变,故KOH溶液的pH保持不变,故C正确;D.因为电池中正负极上为气体参与的反应,所以采用多孔导电材料,可以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触,故D正确;故选B.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目