题目内容
已知反应2X(g)+nY(g)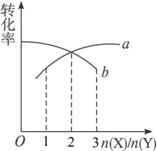
A.图中曲线a为X,n=1 B.图中曲线b为X,n=1
C.图中曲线a为X,n=2 D.图中曲线b为X,n=2
B
解析:化学平衡中物质的转化率随该物质在添加时比例的增加而降低,因此曲线b表示X的转化率的变化;当物质的量之比等于化学计量数之比时,两种反应的转化率相等,故n=1。

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案
相关题目
题目内容
已知反应2X(g)+nY(g)
A.图中曲线a为X,n=1 B.图中曲线b为X,n=1
C.图中曲线a为X,n=2 D.图中曲线b为X,n=2
B
解析:化学平衡中物质的转化率随该物质在添加时比例的增加而降低,因此曲线b表示X的转化率的变化;当物质的量之比等于化学计量数之比时,两种反应的转化率相等,故n=1。

 优百分课时互动系列答案
优百分课时互动系列答案