题目内容
3.四种元素X、Y、Z、E位于元素周期表的前四周期,已知它们的核电荷数依次增大,Y原子的L层p轨道中有2个电子;Z原子的L电子层中,有三个未成对的电子,且无空轨道;E原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1.(1)XYZ分子中的三个原子除X原子外最外层均为8电子构型,根据电子云重叠方式的不同,该分子中共价键的主要类型有σ键、π键.
(2)ZX3是一种常见气体,分子中Z原子的杂化方式是sp3,该物质易液化,极易溶于水,其原因是氨气与氨气、氨气和水分子之间均易形成氢键.
(3)E元素+2价离子的核外电子排布式为1s22s22p63s23p63d10.
分析 Y原子的L层p轨道中有2个电子1s22s22p2,为6号元素碳;Z原子的L电子层中,有三个未成对的电子,且无空轨道,所以Z是氮;E原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1,1s22s22p63s23p63d104s2,30号锌元素,XYZ分子中的三个原子除X原子外最外层均为8电子构型,所以X是氢,由此分析解答.
解答 解:(1)HCN分子中的三个原子除H原子外均为8电子构型,C原子形成4个共价键、N原子形成3个共价键,则HCN分子的结构式为H-C≡N;
共价单键为σ键,共价三键中一个是σ键两个是π键,所以氢氰酸分子中含有两个σ键两个π键,故答案为:σ键、π键;
(2)NH3分子是一种常见气体,氨气分子中N原子价层电子对个数是4,所以N原子采用sp3杂化;氢键的存在增大氨气的溶解性,故答案为:sp3;氨气与氨气、氨气和水分子之间均易形成氢键;
(3)E2+为Zn2+,Zn是30号元素,失去最外层2个电子的核外电子排布式是 1s22s22p63s23p63d10,故答案为:1s22s22p63s23p63d10.
点评 本题考查元素的推断以及分子杂化方式、分子构型、离子核外电子排布等,侧重考查学生分析问题、运用知识解决问题能力,会利用价层电子对互斥理论、构造原理等知识点解答,综合性较强.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.下列关于物质用途的叙述中正确的是( )
| A. | Na2O可用作呼吸面具中的供氧剂 | |
| B. | 在常温下可用铝制容器贮藏运输浓硫酸 | |
| C. | 纯碱可作治疗胃酸过多的一种药剂 | |
| D. | SO2可用于漂白一切有色物质 |
11.苯不能使少量酸性高锰酸钾溶液褪色,但苯的同系物能使少量酸性高锰酸钾溶液褪色,下列解释正确的是( )
| A. | 苯的同系物中原子数比苯分子中原子数多 | |
| B. | 苯环受侧链的影响而易被KMnO4氧化 | |
| C. | 侧链受苯环的影响而易被KMnO4氧化 | |
| D. | 苯环和侧链相互影响,同时被氧化 |
18.在反应4NH3+5O2═4NO+6H2O中,下列说法正确的是( )
| A. | NH3在反应中被氧化 | B. | O2在反应中失去电子 | ||
| C. | NH3在反应中得到电子 | D. | 1mol氧化剂在反应中得到4mol电子 |
8.下列措施能使铁与稀硫酸反应产生氢气的速率加快的是( )
| A. | 加入Na2SO4溶液 | B. | 不用稀硫酸,改用98%浓硫酸 | ||
| C. | 滴加少量CuSO4溶液 | D. | 不用铁片,改用铁粉 |
12.在水电离出的c(H+)=1×10-12 mol/L条件下,下列各组离子一定能大量共存的是( )
| A. | NH4+、AlO2-、Cl-、Na+ | B. | K+、Fe2+、Cl-、NO3- | ||
| C. | Na+、SO 42-、Cl-、Al3+ | D. | Na+、NO3-、K+、SO42- |
13.1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
(一)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
四种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是MgO>CaO>NaCl>KCl
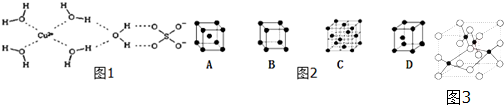
(二)科学家通过X射线推测胆矾中微粒间的作用力,胆矾的结构示意图1可简单表示如下:
(1)胆矾晶体中含有ABC(填字母代号)
A.配位键 B.离子键 C.极性共价键
D.金属键 E.氢 键 F.非极性共价键
(2)Cu2+还能与NH3、Cl-等形成配位数为4的配合物,已知[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为平面正方形.
(3)图2金属铜采用下列C(填字母代号)堆积方式.
(4)图3是铜的某种氧化物的晶胞结构示意图,该晶体的密度为a g/cm3,设阿伏伽德罗常数的值为NA,则该晶胞的体积为$\frac{320}{aN{\;}_{A}}$cm3
(一)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3401 |
(二)科学家通过X射线推测胆矾中微粒间的作用力,胆矾的结构示意图1可简单表示如下:
(1)胆矾晶体中含有ABC(填字母代号)
A.配位键 B.离子键 C.极性共价键
D.金属键 E.氢 键 F.非极性共价键
(2)Cu2+还能与NH3、Cl-等形成配位数为4的配合物,已知[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为平面正方形.
(3)图2金属铜采用下列C(填字母代号)堆积方式.
(4)图3是铜的某种氧化物的晶胞结构示意图,该晶体的密度为a g/cm3,设阿伏伽德罗常数的值为NA,则该晶胞的体积为$\frac{320}{aN{\;}_{A}}$cm3