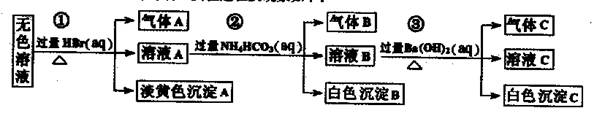
题目内容
下列叙述正确的是( )
| A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) |
| B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 |
| C.pH=11的NaOH的溶液与pH=3的醋酸溶液等体积混合,滴入石蕊试液呈红色 |
D.向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中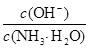 增大 增大 |
C
由电荷守恒可知c(NH4+)+c(H+)=2c(SO42-)+c(OH-),当pH=7时,c(NH4+)=2c(SO42-),故A项错;醋酸是弱酸,浓度越大,电离程度越小,当两溶液pH相差1时,c1≠10c2,B项错;pH=11的NaOH与pH=3的醋酸等体积混合后溶液显酸性,滴入石蕊试液呈红色,C项对;氨水存在电离平衡:NH3·H2O??NH4++OH-,加(NH4)2SO4固体,平衡左移,导致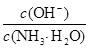 减小,D项错。
减小,D项错。
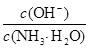 减小,D项错。
减小,D项错。
练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
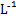 的MgCl2、CuCl2混合溶液中逐滴加入氨水,先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2]
的MgCl2、CuCl2混合溶液中逐滴加入氨水,先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2]