题目内容
某混合溶液中可能含有的离子如下表所示:
为探究其成分,进行了以下探究实验。
(1)探究一:
甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示。
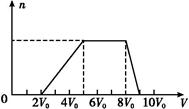
①该溶液中一定不存在的阳离子是 ,
一定不存在的阴离子是 ;含有的阳离子其对应物质的量浓度之比为 ;
②请写出沉淀减少过程中发生反应的离子方程式 。
(2)探究二:
乙同学检测到该溶液中含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
①当起始至通入Cl2的体积为22.4 L时,溶液中发生反应总的离子方程式为 ;
②原溶液中Cl-、Br-、I-的物质的量浓度之比为 。
| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32—、AlO2— |
为探究其成分,进行了以下探究实验。
(1)探究一:
甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示。

①该溶液中一定不存在的阳离子是 ,
一定不存在的阴离子是 ;含有的阳离子其对应物质的量浓度之比为 ;
②请写出沉淀减少过程中发生反应的离子方程式 。
(2)探究二:
乙同学检测到该溶液中含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积(标准状况) | 11.2 L | 22.4 L | 28.0 L |
| n(Cl-) | 2.5 mol | 3.5 mol | 4.0 mol |
| n(Br-) | 3.0 mol | 2.5 mol | 2.0 mol |
| n(I-) | x mol | 0 | 0 |
①当起始至通入Cl2的体积为22.4 L时,溶液中发生反应总的离子方程式为 ;
②原溶液中Cl-、Br-、I-的物质的量浓度之比为 。
(1)①Ag+、Mg2+、Fe3+ CO32—、AlO2—
c(H+)∶c(NH4+)∶c(Al3+)=2∶3∶1
②Al(OH)3+OH- AlO2—+2H2O
AlO2—+2H2O
(2)①4Cl2+2Br-+6I- 8Cl-+Br2+3I2
8Cl-+Br2+3I2
②1∶2∶1
c(H+)∶c(NH4+)∶c(Al3+)=2∶3∶1
②Al(OH)3+OH-
 AlO2—+2H2O
AlO2—+2H2O(2)①4Cl2+2Br-+6I-
 8Cl-+Br2+3I2
8Cl-+Br2+3I2②1∶2∶1
(1)向混合液中滴加NaOH溶液,一开始无沉淀生成,说明含有H+;沉淀量最大时继续滴加NaOH溶液,沉淀的量不变,说明含有NH4+,继续滴加,沉淀量减小直至消失,说明含有Al3+,则一定不含有CO32—、AlO2—(均可与Al3+发生水解反应),一定不含有Ag+、Mg2+、Fe3+(与OH-形成的沉淀不能溶于NaOH);由题目所给数据可得出H+、NH4+、Al3+的物质的量之比为:2∶3∶1;H+(0~2V0),NH4+(5V0~8V0),Al3+(8V0~9V0),沉淀减少段发生的反应为:Al(OH)3+OH- AlO2—+2H2O。
AlO2—+2H2O。
(2)当通入Cl2的体积为11.2 L时,溶液中I-还有剩余,即氯气只与I-反应:Cl2+2I- I2+2Cl-,生成1 mol Cl-,Cl-初始物质的量是(2.5-1)mol="1.5" mol,Br-初始物质的量是3 mol;当通入Cl2 22.4 L时,3.0 mol-2.5 mol="0.5" mol 的Br-被氧化:Cl2+2Br-
I2+2Cl-,生成1 mol Cl-,Cl-初始物质的量是(2.5-1)mol="1.5" mol,Br-初始物质的量是3 mol;当通入Cl2 22.4 L时,3.0 mol-2.5 mol="0.5" mol 的Br-被氧化:Cl2+2Br- Br2+2Cl-,消耗Cl2 0.25 mol,所以Cl2+2I-
Br2+2Cl-,消耗Cl2 0.25 mol,所以Cl2+2I- I2+2Cl-,该反应消耗的Cl2为:1 mol-0.25 mol="0.75" mol,因此原溶液中的I-为:0.75 mol×2="1.5" mol,故原溶液中的Cl-、Br-、I-的物质的量浓度之比为1.5∶3∶1.5=1∶2∶1。通入Cl2 22.4 L时,此时参加反应的Cl2、Br-、I-物质的量之比为:1 mol∶0.5 mol∶1.5 mol=2∶1∶3=4∶2∶6,故离子方程式为:4Cl2+2Br-+6I-
I2+2Cl-,该反应消耗的Cl2为:1 mol-0.25 mol="0.75" mol,因此原溶液中的I-为:0.75 mol×2="1.5" mol,故原溶液中的Cl-、Br-、I-的物质的量浓度之比为1.5∶3∶1.5=1∶2∶1。通入Cl2 22.4 L时,此时参加反应的Cl2、Br-、I-物质的量之比为:1 mol∶0.5 mol∶1.5 mol=2∶1∶3=4∶2∶6,故离子方程式为:4Cl2+2Br-+6I- 8Cl-+Br2+3I2。
8Cl-+Br2+3I2。
 AlO2—+2H2O。
AlO2—+2H2O。(2)当通入Cl2的体积为11.2 L时,溶液中I-还有剩余,即氯气只与I-反应:Cl2+2I-
 I2+2Cl-,生成1 mol Cl-,Cl-初始物质的量是(2.5-1)mol="1.5" mol,Br-初始物质的量是3 mol;当通入Cl2 22.4 L时,3.0 mol-2.5 mol="0.5" mol 的Br-被氧化:Cl2+2Br-
I2+2Cl-,生成1 mol Cl-,Cl-初始物质的量是(2.5-1)mol="1.5" mol,Br-初始物质的量是3 mol;当通入Cl2 22.4 L时,3.0 mol-2.5 mol="0.5" mol 的Br-被氧化:Cl2+2Br- Br2+2Cl-,消耗Cl2 0.25 mol,所以Cl2+2I-
Br2+2Cl-,消耗Cl2 0.25 mol,所以Cl2+2I- I2+2Cl-,该反应消耗的Cl2为:1 mol-0.25 mol="0.75" mol,因此原溶液中的I-为:0.75 mol×2="1.5" mol,故原溶液中的Cl-、Br-、I-的物质的量浓度之比为1.5∶3∶1.5=1∶2∶1。通入Cl2 22.4 L时,此时参加反应的Cl2、Br-、I-物质的量之比为:1 mol∶0.5 mol∶1.5 mol=2∶1∶3=4∶2∶6,故离子方程式为:4Cl2+2Br-+6I-
I2+2Cl-,该反应消耗的Cl2为:1 mol-0.25 mol="0.75" mol,因此原溶液中的I-为:0.75 mol×2="1.5" mol,故原溶液中的Cl-、Br-、I-的物质的量浓度之比为1.5∶3∶1.5=1∶2∶1。通入Cl2 22.4 L时,此时参加反应的Cl2、Br-、I-物质的量之比为:1 mol∶0.5 mol∶1.5 mol=2∶1∶3=4∶2∶6,故离子方程式为:4Cl2+2Br-+6I- 8Cl-+Br2+3I2。
8Cl-+Br2+3I2。
练习册系列答案
相关题目
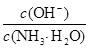 增大
增大 、Cl-、S2-
、Cl-、S2- 、K+
、K+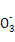 、Mn
、Mn