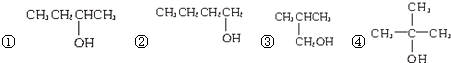题目内容
5.已知食盐固体和SO3在高温下发生反应,生成等体积气体A(黄绿色)和气体B及硫酸钠.(1)食盐固体和SO3在高温下反应的化学方程式为2NaCl+2SO3$\frac{\underline{\;高温\;}}{\;}$SO2↑+Cl2↑+Na2SO4.
(2)将上述反应产生的A和B的混合气体通入品红溶液,溶液不褪色.原因是SO2+Cl2+2H2O=H2SO4+2HCl,硫酸和盐酸都没有漂白性导致溶液不褪色.
(3)若将上述反应产生的A和B的混合气体先通过足量饱和NaHSO3(填化学式)溶液,再通入品红溶液,溶液褪色.
分析 高温条件下,NaCl和SO3反应生成黄绿色气体A、气体B和硫酸钠,黄绿色气体A是Cl2,该反应中Cl元素在反应前后化合价由-1价变为0价,则S得电子化合价由+6价变为+4价,所以气体B是SO2,
(1)A、B在相同条件下体积相等,则反应中计量数相等,再结合原子守恒配平方程式;
(2)SO2、Cl2等体积通入品红溶液中发生反应SO2+Cl2+2H2O=H2SO4+2HCl,硫酸和盐酸都没有漂白性;
(3)次氯酸、二氧化硫都具有漂白性,如果氯气和二氧化硫以1:1通入品红溶液中则溶液不褪色,如果除去二氧化硫或氯气,氯气或二氧化硫通入品红溶液中都褪色.
解答 解:高温条件下,NaCl和SO3反应生成黄绿色气体A、气体B和硫酸钠,黄绿色气体A是Cl2,该反应中Cl元素在反应前后化合价由-1价变为0价,则S得电子化合价由+6价变为+4价,所以气体B是SO2,
(1)A、B在相同条件下体积相等,则反应中计量数相等,再结合原子守恒配平方程式为2NaCl+2SO3$\frac{\underline{\;高温\;}}{\;}$SO2↑+Cl2↑+Na2SO4,
故答案为:2NaCl+2SO3$\frac{\underline{\;高温\;}}{\;}$SO2↑+Cl2↑+Na2SO4;
(2)SO2、Cl2等体积通入品红溶液中发生反应SO2+Cl2+2H2O=H2SO4+2HCl,硫酸和盐酸都没有漂白性,所以溶液不褪色,
故答案为:SO2+Cl2+2H2O=H2SO4+2HCl,硫酸和盐酸都没有漂白性导致溶液不褪色;
(3)次氯酸、二氧化硫都具有漂白性,如果氯气和二氧化硫以1:1通入品红溶液中则溶液不褪色,如果除去二氧化硫或氯气,氯气或二氧化硫通入品红溶液中都褪色,氯气和亚硫酸氢钠反应而二氧化硫和亚硫酸氢钠不反应,所以可以用亚硫酸氢钠除去混合气体中的氯气,再通入品红溶液中,则溶液褪色,
故答案为:NaHSO3.
点评 本题考查物质的漂白性原理,为高频考点,明确次氯酸、二氧化硫漂白原理区别是解本题关键,知道二氧化硫、氯气和水混合时发生的反应,注意:二氧化硫漂白性具有暂时性、次氯酸漂白性具有永久性.

 阅读快车系列答案
阅读快车系列答案| A. | I2发生氧化反应 | B. | 碘电极为该电池的负极 | ||
| C. | 正极反应为:Li-e-═Li+ | D. | 该电池放电时化学能转化为电能 |
| A. | 推广或使用新能源汽车有助于减少氮氧化物的排放 | |
| B. | “硫黄姜”又黄又亮,可能是在用硫黄熏制过程中产生的SO2所致 | |
| C. | 华裔科学家高琨在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的晶体硅 | |
| D. | 原子吸收光谱仪可用于测定物质中的金属元素,红外光谱仪可用于测定化合物中的官能团 |
| A. | 实验室采用排饱和食盐水的方法收集氯气 Cl2+H2O?H++Cl-+HClO | |
| B. | 500℃左右的温度比室温更有利于合成氨反应N2(g)+3H2(g)?2NH3(g)△H<0 | |
| C. | H2、I2、HI平衡混合气体加压后颜色加深 H2(g)+I2(g)?2HI(g) | |
| D. | SO2氧化为SO3,往往需要使用催化剂 2SO2(g)+O2(g)?2SO3(g) |
 )分子的一氯代物有2种.
)分子的一氯代物有2种. 系统命名为3-甲基-2-乙基-1-丁烯
系统命名为3-甲基-2-乙基-1-丁烯 请写出其单体结构:
请写出其单体结构: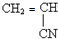 、
、 、
、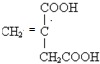 .
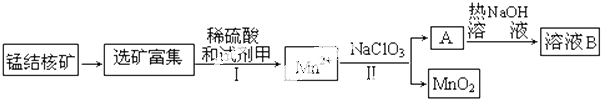
.
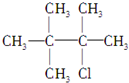
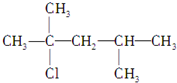
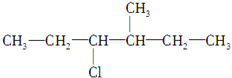
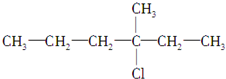
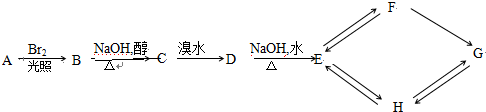
 .
.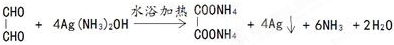 .
.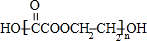 .
.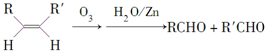
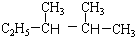 )的系统命名法的名称是2,3-二甲基戊烷;
)的系统命名法的名称是2,3-二甲基戊烷;