题目内容
【题目】某班同学用如下实验探究过氧化氢的性质。回答下列问题:
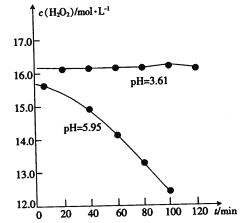
(1)甲组同学拟配制5%的H2O2溶液,他们先从文献查得H2O2的稳定性与pH的关系如图所示。则配制H2O2溶液时应滴入几滴_____________(填“稀硫酸”或“氨水”)。
(2)乙组同学向一支试管中加入2mLFeCl2溶液,再滴入几滴甲组同学配制的H2O2溶液,最后滴人KSCN溶液,溶液变红,H2O2与Fe2+发生反应的离子方程式为_________________;另取一支试管,向其中加入SO2与BaCl2混合溶液2mL,再滴入几滴5%的H2O2溶液,现象是_____________。
(3)丙组同学取2mLKMnO4溶液于试管中,向其中滴几滴5%的H2O2溶液,发现溶液逐渐褪色,该反应中的还原剂是____________(填化学式)。
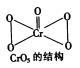
(4)丁组同学向一支试管中加入2mL5%的H2O2溶液、0.5mL乙醚、1mLlmol/LH2SO4溶液和3~4滴0.5mol/LK2Cr2O7溶液,发现上层乙醚层为蓝色(CrO5的乙醚溶液),一段时间后上层蓝色消失。
①乙醚的主要作用是____________。
②开始时,H2O2溶液与K2Cr2O7酸性溶液反应生成CrO5,该反应属于____________(填“氧化还原”或“非氧化还原”)反应。
③一段时间后,乙醚层中的CrO5与水相中的H+作用生成Cr3+并产生无色气泡,从而使蓝色逐渐消失,该反应的离子方程式为____________________。
【答案】
(1)稀硫酸(1分)
(2)2Fe2++H2O2+2H+=2Fe3++2H2O(2分);产生白色沉淀(1分)
(3)H2O2(1分)
(4)①萃取CrO5(2分)
②非氧化还原(1分)
③4CrO5+12H+=4Cr3++7O2↑+6H2O(2分)
【解析】
试题分析:(1)由H2O2的稳定性与pH的关系图可知,pH=3.61的溶液中更能长时间保持H2O2不分解,所以配制H2O2溶液时应滴入几滴稀硫酸。
(2)滴人KSCN溶液,溶液变红,说明H2O2将Fe2+氧化为Fe3+,发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。SO2与BaCl2混合溶液中滴入H2O2溶液,H2O2将SO2氧化为SO42-,与BaCl2溶液反应产生BaSO4白色沉淀。
(3)KMnO4溶液中滴H2O2逐渐褪色,发生反应2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,说明KMnO4为氧化剂,H2O2为还原剂。
(4)①乙醚与水分层,且上层乙醚层为CrO5的乙醚溶液,则乙醚可作为萃取剂萃取CrO5。
②从CrO5的结构可知,一个O是-2价其余4个O是-1价,则Cr为+6价。K2Cr2O7中Cr也为+6价,所以该反应属于非氧化还原反应。
③CrO5生成Cr3+并产生无色气泡即O2,反应的离子方程式为4CrO5+12H+=4Cr3++7O2↑+6H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
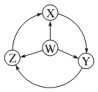
小学生10分钟应用题系列答案【题目】如图W、X、Y、Z为四种物质,若箭头表示能一步转化的常见反应,其中常温下能实现图示转化关系的是
选项 | W | X | Y | Z |
|
A | S | SO2 | SO3 | H2SO4 | |
B | Na | Na2O2 | NaOH | NaCl | |
C | Fe | FeCl3 | Fe(OH)2 | FeCl2 | |
D | Al | AlCl3 | Na[Al(OH)4] | Al2(SO4)3 |
A. A B. B C. C D. D