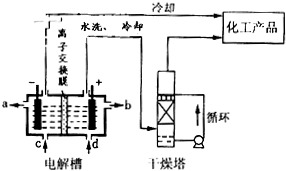
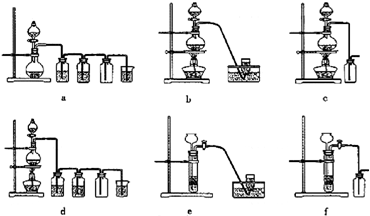
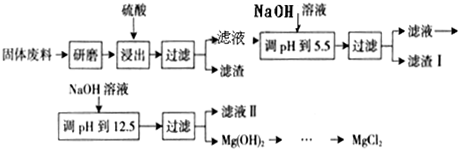
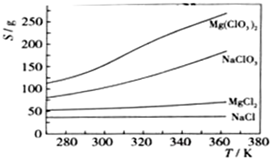
题目内容
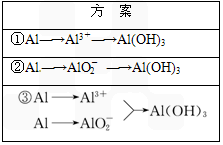
以Al制备Al(OH)3的实验,课本中提出了三种设计方案,并列表对比如下:途径 | 生成1 mol Al(OH)3消耗H+或OH-的物质的量/mol |
|
| 消耗H+ | 消耗OH- |
1.Al→Al3+→Al(OH)3 | 3 | 3 |
2.Al→ | 1 | 1 |
|
|
|
(1)制备相同物质的量的Al(OH)3消耗酸和碱最少的方案是______________(填序号);按此方案,每制备1 mol Al(OH)3,理论上至少消耗H2SO4____________mol,NaOH_______________mol。
(2)有同学按课本方案3进行试验,将铝粉(未被氧化)以1∶3质量比分别溶于酸、碱溶液中,结果发现不但耗酸量和耗碱量都大于理论用量,且生成的Al(OH)3也大大减少,你认为产生此结果的原因可能是________________________________________________。
(3)该同学根据方案3中Al全部转入Al(OH)3,溶液中只有Na2SO4这一事实,设计了不用天平,只用量筒就可使Al完全转化为Al(OH)3,且酸碱的利用率达到最大的方案,请你分析该同学所取NaOH溶液和H2SO4溶液中溶质的物质的量之比为________________;所加Al粉的量为________________(填“少量”或“过量”);请你写出后续实验步骤________________。
(1)3 3/8 3/4
(2)因为Al只有在过量的酸或碱中才能完全溶解,所以实际耗酸、碱的量大于理论用量;过量的酸和碱中和后,多余的酸或碱能继续溶解Al(OH)3,所以Al(OH)3的量会减少。
(3)2∶1 过量 待Al粉与酸、碱溶液充分反应后过滤,并洗涤剩余的Al粉,将洗涤液及两份滤液混合,产生Al(OH)3沉淀。再过滤、洗涤、干燥得Al(OH)3。
解析:(2)要使铝粉全部溶解,酸、碱必须都过量,所以耗酸量和耗碱量都大于理论用量;过量的酸和碱中和后,剩余的酸或碱能继续溶解Al(OH)3,使生成的Al(OH)3的量减少。(3)根据Na、S守恒可知:NaOH和H2SO4的物质的量之比为2∶1;所加Al粉应过量,才会使NaOH和H2SO4都反应。

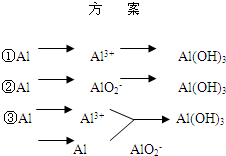 实验室可用铝屑、氨水、氢氧化钠溶液、稀硫酸等来制备氢氧化铝,某同学设计了三种方案,
实验室可用铝屑、氨水、氢氧化钠溶液、稀硫酸等来制备氢氧化铝,某同学设计了三种方案,