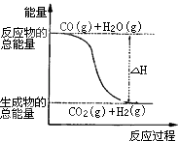
��Ŀ����
����Ŀ������A��B��C��D��E��F���ֶ�����Ԫ�أ����ǵ�ԭ��������������A��Dͬ���壮C��Eͬ���壬D��E��Fͬ���ڣ�A��B������������֮����C��������������ȣ�A�ֱܷ���B��C�γɵ���������ȵķ��ӣ���A��C�γɵĻ����ﳣ����ΪҺ̬��A�ֱܷ���E��F�γɵ���������ȵ�������ӣ�
��ش��������⣨���е���ĸֻ����Ԫ�ش��ţ���ʵ��Ԫ�ط����أ���
��1��A��F����Ԫ�أ�����������ˮ�����Լ��Ե�Ԫ�������ڱ��е�λ������
��2��A��C��D����Ԫ����ɵ�һ�ֳ�������������Ҫ�Ĺ�ҵ��Ʒ���û����ﺬ�еĻ�ѧ��Ϊ��
��3��B��F����Ԫ���γɵ�һ�ֻ�������ӣ���ԭ�Ӿ���8e���ȶ��ṹ���õ���ʽ��ʾ�û�������γɹ�����
��4��E������������ˮ�������ΪǦ���صĵ������Һ��д���õ�طŵ�ʱ����������ʽ������ ��
��5���Ƚ�E��F�ķǽ�����ǿ����EF������ڻ�С�ڣ���д��������֤�ý��۵�һ����ѧ����ʽ�� ��
���𰸡�
��1���������ڵ�IA��
��2�����Ӽ������ۼ�
��3��![]()
��4��PbO2+2e��+4H++SO42��=PbSO4+2H2O
��5��С�ڣ�Cl2+H2S=S+2HCl��Cl2+Na2S=S+2NaCl
���������⣺A��B��C��D��E��F���ֶ�����Ԫ�أ����ǵ�ԭ��������������C��Eͬ���壬��֪C���ڵڶ����ڡ�E���ڵ������ڣ���D��E��F���ڵ������ڣ�A��Dͬ���壬����������С��C�ģ�A��C�γɵ����ֻ������ڳ����¾�ΪҺ̬����AΪHԪ�أ�CΪOԪ�أ�EΪSԪ�أ�DΪNa��A��B������������֮����C��������������ȣ���B������������Ϊ5�����ԭ����������֪BΪNԪ�أ�HԪ������NԪ�ء�OԪ���γɵ�������ȵķ��ӣ�A�ֱܷ���E��F�γɵ���������ȵ�������ӣ�����Ӻ��е�����Ϊ18��F��ԭ�����������FΪClԪ�أ�
��1.��A��F����Ԫ�أ�����������ˮ�����Լ�����Na�������ڱ��е�λ���ǣ��������ڵ�IA�壬���Դ��ǣ��������ڵ�IA�壻
��2.��A��C��D����Ԫ����ɵ�һ�ֳ���������ΪNaOH���������Ӽ������ۼ������Դ��ǣ����Ӽ������ۼ���
��3.��B��F����Ԫ���γɵ�һ�ֻ�������ӣ���ԭ�Ӿ���8e���ȶ��ṹ���÷���ΪNCl3 �� �õ���ʽ��ʾ�û�������γɹ��� 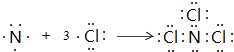 ��
��
���Դ��ǣ� 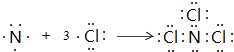 ��
��
��4.��E������������ˮ����Ϊ���ᣬ����ΪǦ���صĵ������Һ������������ԭ��Ӧ���õ�طŵ�ʱ����������ʽ��PbO2+2e��+4H++SO42��=PbSO4+2H2O�����Դ��ǣ�PbO2+2e��+4H++SO42��=PbSO4+2H2O��
��5.��ͬ����������ҷǽ����Լ������ʷǽ�����SС��Cl�ģ�������֤�ý��۵�һ����ѧ����ʽ��Cl2+H2S=S+2HCl��Cl2+Na2S=S+2NaCl�����Դ��ǣ�С�ڣ�Cl2+H2S=S+2HCl��Cl2+Na2S=S+2NaCl��

����Ŀ�����в��ֶ�����Ԫ�ص����ʻ�ԭ�ӽṹ�����
Ԫ�ر�� | Ԫ�����ʻ�ԭ�ӽṹ |
A | ���������Ӳ㣬K��M�������֮�͵���L������� |
B | �������н�������ǿ |
C | �����µ���Ϊ˫ԭ�ӷ��ӣ��⻯���ˮ��Һ�ʼ��� |
D | Ԫ�����������+7�� |
��1���û�ѧ����ش��������⣺
��AԪ�������ڱ��е�λ����
��C���ʷ��ӵĵ���ʽ��
��D��ԭ�ӽṹʾ��ͼ��
�ܵ���ʽ��ʾA��BԪ����ɵĻ�������γɹ��̣� ��
��2��Ԫ��D��Ԫ��A��ȣ��ǽ����Խ�ǿ��������Ԫ�ط��ű�ʾ�������б�������֤����һ��ʵ��������ѡ����ţ���
a��������D�ĵ��ʺ�A�ĵ���״̬��ͬ
b��D���⻯���A���⻯���ȶ�
c��һ��������D��A�ĵ��ʶ������Ʒ�Ӧ
d��A��ۺ��������������D��ۺ�����
e��D��������A���⻯�ﷴӦ����A����
��3��X����A��B��C��D����Ԫ���е�ij��Ԫ����ɵĵ��ʣ��ܾ�ͼ��ʾ�Ĺ���ת��Ϊ������������ȥ���� ![]()
����Y���д̼�����ζ����ɫ���壬��Yͨ��BaCl2��Һ�У�������Ȼ��μ�����H2O2��Һ���а�ɫ�������ɣ���ð�ɫ����Ϊ �� ��д��Y��H2O2��Һ��Ӧ�Ļ�ѧ����ʽ����
����Z�Ǻ���ɫ���壬��Z��W�ķ�Ӧ���������뻹ԭ�����ʵ���֮��Ϊ ��