题目内容
【题目】CuSO4溶液与K2C2O4溶液棍合反应,产物之一是某种只含一种阴离子的蓝色钾盐水合物。通过下述实验确定该晶体的组成。
步骤a:称取0.6720 g样品,放入锥形瓶,加入适量2 mol·L-1稀硫酸,微热使样品溶解。再加入30 ml水加热,用0.2000 mol·L-1 KMnO4溶液滴定至终点,消耗8.00 mlKMnO4溶液。
步骤b:接着将溶液充分加热,使淡紫红色消失,溶液最终呈现蓝色。冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI。用0.2500 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗8.00 ml Na2S2O3溶液。已知涉及的部分反应的离子方程式为:
I2+2S2O32-=2I+S4O62-
(1)已知室温下CuI的Ksp=1.27×10-12,欲使溶液中c(Cu )≤1.0×10-6 mol·L-1,应保持溶液中c(I-)≥ mol·L-1。
(2)MnO4-在酸性条件下,加热能分解为O2,同时生成Mn2+。写出该反应的离子方程式为 若无此加热操作,则测定的Cu2+的含量将会 (填“偏高”、“偏低”或“不变”)。
(3)步骤b中第一步反应的方程式为 ,若用淀粉溶液做指示剂,则滴定终点观察到的现象为 。
(4)通过计算确定样品晶体的组成。(请写出计算过程)
【答案】
(1)1.27×10-6
(2)4MnO4-+12H+![]() 4Mn2++5O2↑+6H2O;偏高;
4Mn2++5O2↑+6H2O;偏高;
(3)2Cu2++4I-=2CuI↓+I2 溶液由蓝色变为无色,且半分钟内不变色
(4)K2Cu(C2O4)2·H2O
【解析】
试题分析:(1)CuI的Ksp=1.27×10-12=c(Cu+)c(I-),c(I-)=![]() =
=![]() ,由于溶液中c(Cu+)≤1.0×10-6molL-1,c(I-)≥1.27×10-6,故答案为:1.27×10-6;
,由于溶液中c(Cu+)≤1.0×10-6molL-1,c(I-)≥1.27×10-6,故答案为:1.27×10-6;
(2)锰元素化合价+7→+2,降低了5价,生成氧气,氧元素化合价-2→0,升高了2×2=4,所以锰离子前配4,氧气前配5,再利用观察法配平其它物质,反应的离子方程式是:4MnO4-+12H+ ![]() 4Mn2++5O2↑+6H2O;若不加热除去高锰酸根离子,高锰酸根离子能够氧化碘离子,使得碘单质的物质的量增加,测定铜离子含量偏高,故答案为:4MnO4-+12H+
4Mn2++5O2↑+6H2O;若不加热除去高锰酸根离子,高锰酸根离子能够氧化碘离子,使得碘单质的物质的量增加,测定铜离子含量偏高,故答案为:4MnO4-+12H+ ![]() 4Mn2++5O2↑+6H2O;偏高;
4Mn2++5O2↑+6H2O;偏高;
(3)根据反应I2+2S2O32-=2I-+S4O62-,当反应结束时,溶液的蓝色消失变成无色溶液,所以滴定终点是:溶液由蓝色变为无色,且半分钟内不变色,故答案为:溶液由蓝色变为无色,且半分钟内不变色;
(4)根据反应2MnO4-+5C2O42-+16H+=2Mn2++8H2O+10CO2↑、2Cu2++4I-=2CuI↓+I2 I2+2S2O32-=2I-+S4O62-
可得关系式:2MnO4- ~ 5C2O42-
2 5
0.2×8×10-3mol n(C2O42-)
2S2O32-~I2~2Cu2+
2 2
0.25×8×10-3mol n(Cu2+)
所以n(C2O42-)=4×10-3mol,n(Cu2+)=2×10-3mol,根据电荷守恒原理:n(K+)=2n(C2O42-)-2n(Cu2+)=4×10-3mol,根据质量守恒原理:m(H2O) = 0.6720 – 39 × 4 × 10-3 – 64 × 2 × 10-3 – 88 × 4 × 10-3 = 0.036g ,n(H2O) =2 ×10-3 ,n (K+) :n(Cu2+) :n(C2O42-) :n (H2O) = 2 :1:2:1,所以样品晶体组成是:K2Cu(C2O4)2H2O,答:该样品晶体的化学式为:K2Cu(C2O4)2H2O.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案【题目】
(1)如图所示的仪器中配制溶液肯定不需要的是_______________(填序号),配制上述溶液还需用到的玻璃仪器是____________(填仪器的名称)。
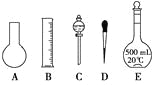
(2)下列操作中,容量瓶所不具备的功能有________(填序号)。
A.配制一定体积准确浓度的标准溶液 |
B.贮存溶液 |
C.测量容量瓶规格以下的任意体积的液体 |
D.准确稀释某一浓度的溶液 |
E.量取一定体积的液体
F.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度________0.1 mol/L(填“大于”、“等于”或“小于”,下同)。若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度________0.1 mol/L。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为________mL(计算结果保留一位小数)。如果实验室有15 mL、20 mL、50 mL量筒,应选用________mL量筒最好。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是______________________。

