题目内容
 某种优质燃油由甲、乙两种有机物混合而成,甲、乙两种物质含有C、H、O三种元素中的两种或三种.已知甲、乙及CO、H2的燃烧热如下:
某种优质燃油由甲、乙两种有机物混合而成,甲、乙两种物质含有C、H、O三种元素中的两种或三种.已知甲、乙及CO、H2的燃烧热如下:| 物质 | 甲 | 乙 | CO | H2 |
| 燃烧热/kJ?mol-1 | 1366 | 5518 | 283 | 286 |
(1)乙的相对分子质量为
114
114
;(2)160g由甲、乙等物质的量混合而成的燃油在347.2LO2中恰好完全燃烧,得492.8L气体,冷却到室温时,还剩余224L(气体体积均在标准状况下测定).由此可求得混合物中C、H、O的原子个数比
10:24:1
10:24:1
.甲、乙的分子式为:甲C2H6O
C2H6O
;乙C8H18
C8H18
.(3)1mol由甲、乙等物质的量混合而成的燃油在一定量的O2中燃烧,放出热量2876kJ?mol-1,则反应中生成CO
2
2
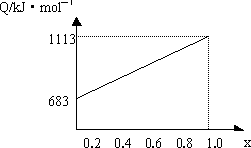
mol.分析:(1)依据图象分析乙的质量分数为100%时放热1113KJ,结合乙的燃烧热是1mol乙完全燃烧生成稳定氧化物放出的热量计算出乙的物质的量,根据摩尔质量概念计算得到;当全部是甲物质放热683KJ,结合甲的燃烧热计算甲的物质的量,计算摩尔质量;
(2)混合物燃烧冷却到室温时,还剩余224L为二氧化碳气体,水蒸气为492.8L-224L=268.8L,依据原子守恒分别计算碳、氢、氧元素的物质的量得到原子个数比;甲、乙等物质的量混合结合混合物质量和甲乙的摩尔质量计算得到物质的量推断出分子式;
(3)根据燃烧的热量变化,结合一氧化碳的燃烧热计算一氧化碳的物质的量.
(2)混合物燃烧冷却到室温时,还剩余224L为二氧化碳气体,水蒸气为492.8L-224L=268.8L,依据原子守恒分别计算碳、氢、氧元素的物质的量得到原子个数比;甲、乙等物质的量混合结合混合物质量和甲乙的摩尔质量计算得到物质的量推断出分子式;
(3)根据燃烧的热量变化,结合一氧化碳的燃烧热计算一氧化碳的物质的量.
解答:解:(1)当X=1.0燃油全部是乙,根据乙的燃烧热计算乙的物质的量,n(乙)=
=0.2017mol;则M(乙)=
=114g/mol;
当X=0时,燃油全部是甲,依据甲的燃烧热计算甲的物质的量=
=0.5mol,则M(甲)=
=46g/mol;
故答案为:114;
(2)160g混合物燃烧生成二氧化碳物质的量为n(CO2)=
=10mol;
生成水的物质的量为n(H2O)=
=12mol;
根据二氧化碳和水中的氧元素之和与消耗氧气的氧元素差值计算;347.2LO2物质的量=
=15.5mol;
得到原混合物中含氧元素物质的量为n(O)=10×2+12-15.5×2=1mol;
所以n(C):n(H):n(O)=10:24:1;
设160g混合物物质的量为n,甲乙等物质的量混合,则114n+46n=160,得到n=1;摩尔质量为46g/mol的是乙醇;依据原子守恒得到乙的分子式为C8H18
所以甲的分子式为C2H6O;乙的分子式为:C8H18,
故答案为:10:24:1;C2H6O;C8H18;
(3)1mol混合物完全燃烧应放热=
=3442KJ;实际放热2876KJ;
所以生成一氧化碳的物质的量结合一氧化碳的燃烧热计算得到:n(CO)=
=2mol;
故答案为:2.
| 1113KJ |
| 5518KJ/mol |
| 23g |
| 0.2017mol |
当X=0时,燃油全部是甲,依据甲的燃烧热计算甲的物质的量=
| 683KJ |
| 1366KJ/mol |
| 23g |
| 0.5mol |
故答案为:114;
(2)160g混合物燃烧生成二氧化碳物质的量为n(CO2)=
| 224L |
| 22.4L/mol |
生成水的物质的量为n(H2O)=
| 492.8L-224L |
| 22.4L/mol |
根据二氧化碳和水中的氧元素之和与消耗氧气的氧元素差值计算;347.2LO2物质的量=
| 347.2L |
| 22.4L/mol |
得到原混合物中含氧元素物质的量为n(O)=10×2+12-15.5×2=1mol;
所以n(C):n(H):n(O)=10:24:1;
设160g混合物物质的量为n,甲乙等物质的量混合,则114n+46n=160,得到n=1;摩尔质量为46g/mol的是乙醇;依据原子守恒得到乙的分子式为C8H18
所以甲的分子式为C2H6O;乙的分子式为:C8H18,
故答案为:10:24:1;C2H6O;C8H18;
(3)1mol混合物完全燃烧应放热=
| 1336KJ+5518KJ |
| 2 |
所以生成一氧化碳的物质的量结合一氧化碳的燃烧热计算得到:n(CO)=
| 3442KJ-2876KJ |
| 283KJ/mol |
故答案为:2.
点评:本题考查了燃烧热的概念应用和计算,主要是图象分析计算甲、乙的摩尔质量,混合物的综合计算,原子守恒是解题关键,题目难度中等.

练习册系列答案
相关题目
某种优质燃油由甲、乙两种有机物混合而成,甲、乙两种物质含有C、H、O三种元素中的两种或三种。已知甲、乙及CO、![]() 的燃烧热如下:
的燃烧热如下:
| 物质 | 田 | 乙 | CO |
|
| 燃烧热/( | 1366 | 5518 | 283 | 286 |
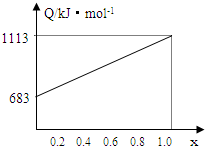
取甲、乙按不同比例混合的燃油23g,在足量的![]() 中燃烧时,放出的热量Q与混合物中乙的物质的量分数x的关系如图所示。试求:
中燃烧时,放出的热量Q与混合物中乙的物质的量分数x的关系如图所示。试求:
(1)乙的相对分子质量Mr(乙) ;
(2)160g由甲、乙等物质的量混合而成的燃油在347.2L![]() 中恰好完全燃烧,得492.8L气体,冷却到室温时,还剩余224L(气体体积均在标准状况下测定)。由此可求得混合
中恰好完全燃烧,得492.8L气体,冷却到室温时,还剩余224L(气体体积均在标准状况下测定)。由此可求得混合
物中C、H、O的原子个数比为 ,甲、乙的分子式为:甲 ;乙
(3)1mol由甲、乙等物质的量混合而成的燃油在一定量的![]() 中燃烧,放出热量2876
中燃烧,放出热量2876![]() ,则反应中生成CO为 mol。
,则反应中生成CO为 mol。
某种优质燃油由甲、乙两种有机物混合而成,甲、乙两种物质含有C、H、O三种元素中的两种或三种.已知甲、乙及CO、H2的燃烧热如下:
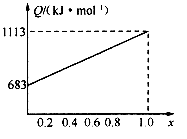
取甲、乙按不同比例混合的燃油23g,在足量的O2中燃烧时,放出的热量Q与混合物中乙的物质的量分数x的关系如图.试求:
(1)乙的相对分子质量为______;
(2)160g由甲、乙等物质的量混合而成的燃油在347.2LO2中恰好完全燃烧,得492.8L气体,冷却到室温时,还剩余224L(气体体积均在标准状况下测定).由此可求得混合物中C、H、O的原子个数比______.甲、乙的分子式为:甲______;乙______.
(3)1mol由甲、乙等物质的量混合而成的燃油在一定量的O2中燃烧,放出热量2876kJ?mol-1,则反应中生成CO______mol.

| 物质 | 甲 | 乙 | CO | H2 |
| 燃烧热/kJ?mol-1 | 1366 | 5518 | 283 | 286 |
(1)乙的相对分子质量为______;
(2)160g由甲、乙等物质的量混合而成的燃油在347.2LO2中恰好完全燃烧,得492.8L气体,冷却到室温时,还剩余224L(气体体积均在标准状况下测定).由此可求得混合物中C、H、O的原子个数比______.甲、乙的分子式为:甲______;乙______.
(3)1mol由甲、乙等物质的量混合而成的燃油在一定量的O2中燃烧,放出热量2876kJ?mol-1,则反应中生成CO______mol.