题目内容
已知甲、乙、丙均是中学化学中常见的物质。回答下列问题:(1)甲、乙、丙有如下转化关系,且甲的化学式为RCl3,其溶液在加热蒸干并灼烧时发生反应:
甲+水![]() 乙+丙,乙
乙+丙,乙![]() 氧化物+H2O
氧化物+H2O
①若甲是某种用途广泛的金属元素的氧化物,在上述变化中生成的氧化物为红棕色粉末,则该金属元素在周期表中的位置是_______________。
②若甲是某种短周期金属元素的氯化物,则R是_______________(填元素名称)。
③将①②中的两种金属单质用导线连接后插入氢氧化钠溶液中构成原电池。该原电池中负极上的电极反应式是______________________________。
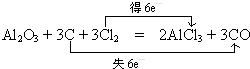
(2)甲、乙、丙均是第2周期元素形成的单质或化合物,常温下乙为固体单质,甲和丙均为气态化合物,且可发生反应:甲+乙![]() 丙。则:
丙。则:
①丙在高温时是一种还原剂,请用化学方程式表示它在工业上的一种重要用途:___________
_______________________________________________________________________________。
②写出单质乙与浓HNO3反应的化学方程式___________________________________________。
(1)①第4周期Ⅷ族 ②铝 ③Al-3e-+4OH-====AlO![]() +2H2O
+2H2O
(2)①3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
②C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
解析:(1)①根据题给信息,氧化物为红棕色粉末,则为Fe2O3,甲为Fe,在周期表中位于第4周期Ⅷ族。
②若甲是短周期金属元素,则甲只能是铝。
③Al、Fe插入NaOH溶液中构成原电池,则Al作负极,Fe作正极。
(2)根据题给信息,可确定甲为CO2,乙为C,丙为CO。

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目