题目内容
(1)在V L Al2(SO4)3溶液中,测得含Al3+的质量为a g,则Al2(SO4)3溶液的物质的量浓度为
mol/L
mol/L,SO42-的物质的量浓度为
mol/L
mol/L.
(2)在标准状况下,4g H2、11.2L O2、1mL H2O中,所含分子数最多的是
(3)在同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为
| a |
| 54 |
| a |
| 54 |
| a |
| 18 |
| a |
| 18 |
(2)在标准状况下,4g H2、11.2L O2、1mL H2O中,所含分子数最多的是
4gH2
4gH2
,含原子数最多的是4gH2
4gH2
,质量最大的是11.2LO2
11.2LO2
,体积最小的是1mLH2O
1mLH2O
.(3)在同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为
1:1
1:1
,物质的量之比为1:1
1:1
,原子总数之比为5:3
5:3
,质量之比为4:11
4:11
,密度之比为4:11
4:11
.分析:(1)先根据n=
计算铝离子的物质的量,根据c=
计算Al3+的物质的量浓度,Al2(SO4)3溶液的物质的量浓度为铝离子浓度的
,然后根据c(Al3+):c(SO42-)=2:3计算SO42-的物质的量浓度;
(2)根据m=ρV计算水的质量,根据n=
=
计算各物质的物质的量,物质的量越大含有分子数越多,结合分子含有原子数目计算原子物质的量,原子物质的量越大含有原子数目越多;计算氧气的质量,据此判断质量大小,计算氢气的体积比较大小;
(3)同温同压下,同体积的气体含有相同的分子数目、分子物质的量相同,结合分子含有的原子数目判断原子总数之比,根据m=nM计算质量之比,同温同压下密度之比等于摩尔质量之比.
| m |
| M |
| n |
| V |
| 1 |
| 2 |
(2)根据m=ρV计算水的质量,根据n=
| m |
| M |
| V |
| Vm |
(3)同温同压下,同体积的气体含有相同的分子数目、分子物质的量相同,结合分子含有的原子数目判断原子总数之比,根据m=nM计算质量之比,同温同压下密度之比等于摩尔质量之比.
解答:解:(1)ag铝离子的物质的量为
=
mol,Al3+的物质的量浓度为
=
mol/L,Al2(SO4)3溶液的物质的量浓度为铝离子浓度的
,故Al2(SO4)3溶液的物质的量浓度为
mol×
=
mol/L,
根据c(Al3+):c(SO42-)=2:3可知,SO42-的物质的量浓度为
mol/L×
=
mol/L,
故答案为:
mol/L;
mol/L;
(2)4g H2的物质的量为2mol,11.2L O2的物质的量为
=0.5mol,水的质量为1g,水的物质的量为
=
mol,物质的量越大含有分子数越多,故4g H2含有分子数目最多;
4g H2含有原子为4mol、11.2L O2含有原子为1mol、1mL H2O含有原子为
mol,原子物质的量越大含有原子数目越多,故4g H2含有原子数目最多;
氧气的质量为0.5mol×32g/mol=16g,故11.2L O2的质量最大;
4g H2的体积为2mol×22.4L/mol=44.8L,故1mL H2O的体积最小,
故答案为:4g H2;4g H2;11.2L O2;1mL H2O;
(3)同温同压下,同体积的甲烷(CH4)和二氧化碳含有相同的分子数目为1:1,分子物质的量相同为1:1,分子含有的原子数目总数之比为1×5:1×3=5:3,二者质量之比为1×16:1×44=4:11,同温同压下密度之比等于摩尔质量之比为16g/mol:44g/mol=4:11,
故答案为:1:1;1:1;5:3;4:11;4:11.
| ag |
| 27g/mol |
| a |
| 27 |
| ||
| VL |
| a |
| 27 |
| 1 |
| 2 |
| a |
| 27 |
| 1 |
| 2 |
| a |
| 54 |
根据c(Al3+):c(SO42-)=2:3可知,SO42-的物质的量浓度为
| a |
| 27 |
| 3 |
| 2 |
| a |
| 18 |
故答案为:
| a |
| 54 |
| a |
| 18 |
(2)4g H2的物质的量为2mol,11.2L O2的物质的量为
| 11.2L |
| 22.4L/mol |
| 1g |
| 18g/mol |
| 1 |
| 18 |
4g H2含有原子为4mol、11.2L O2含有原子为1mol、1mL H2O含有原子为
| 1 |
| 6 |
氧气的质量为0.5mol×32g/mol=16g,故11.2L O2的质量最大;
4g H2的体积为2mol×22.4L/mol=44.8L,故1mL H2O的体积最小,
故答案为:4g H2;4g H2;11.2L O2;1mL H2O;
(3)同温同压下,同体积的甲烷(CH4)和二氧化碳含有相同的分子数目为1:1,分子物质的量相同为1:1,分子含有的原子数目总数之比为1×5:1×3=5:3,二者质量之比为1×16:1×44=4:11,同温同压下密度之比等于摩尔质量之比为16g/mol:44g/mol=4:11,
故答案为:1:1;1:1;5:3;4:11;4:11.
点评:本题考查常用化学计量的有关计算、分子中原子数目的计算、阿伏伽德罗定律等,难度不大,侧重对基础知识的巩固.

练习册系列答案
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
 (2013?青岛一模)碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.
(2013?青岛一模)碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.
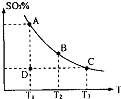 (1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为:2SO2(g)+O2(g)?2SO2(g),反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
(1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为:2SO2(g)+O2(g)?2SO2(g),反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题: