题目内容
(18分)U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)V的单质分子的结构式为_______________;XW的电子式为____________;
Y元素在周期表中的位置是___________ __。
(2)U元素形成的同素异形体的晶体类型可能是(填序号) 。
①原子晶体 ②离子晶体 ③分子晶体 ④金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)____________;V、W的氢化物分子结合H+能力较强的是(写化学式)______________;U的氢化物的标准燃烧热为-890.31kJ·mol-1,请写出其燃烧的热化学方程式:
(4)YW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为__________________________________________,由此可知VW和YW2还原性较强的是(写化学式)______________________________。
请回答下列问题:
(1)V的单质分子的结构式为_______________;XW的电子式为____________;
Y元素在周期表中的位置是___________ __。
(2)U元素形成的同素异形体的晶体类型可能是(填序号) 。
①原子晶体 ②离子晶体 ③分子晶体 ④金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)____________;V、W的氢化物分子结合H+能力较强的是(写化学式)______________;U的氢化物的标准燃烧热为-890.31kJ·mol-1,请写出其燃烧的热化学方程式:
(4)YW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为__________________________________________,由此可知VW和YW2还原性较强的是(写化学式)______________________________。

 (1)N≡N;
(1)N≡N;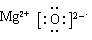 ;第三周期ⅥA族。(2) ①③
;第三周期ⅥA族。(2) ①③ (3)CH4; NH3, CH4(g) +2O2(g)=CO2(g)+2H2O(l) △H=-890.31KJ·mol-1。
(4)3SO2+3Ba2+ +2H2O +2NO3- =3BaSO4↓+2NO↑ + 4H+, SO2。
Y的单质在W2中燃烧的产物可使品红溶液褪色,所以Y是S,W是O元素;Z和W元素形成的化合物Z3W4具有磁性,因此Z是Fe。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体,因此U是碳,X是镁。营业务U、V、W、X、Y、Z是原子序数依次增大的六种常见元素,所以V是氮元素。
(1)氮气中含有氮氮三键,所以气结构式是N≡N;XW是氧化镁,氧化镁是含有离子键的离子化合物,电子式为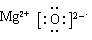 。S元素的原子序数是16,位于第三周期ⅥA族。由于氨水是弱碱,所以氨气极易结合氢离子生成NH4+。
。S元素的原子序数是16,位于第三周期ⅥA族。由于氨水是弱碱,所以氨气极易结合氢离子生成NH4+。
(2)在碳元素形成的单质中金刚石是原子晶体,而C60是分子晶体,不存在离子晶体和金属晶体,答案选①③。
(3)U、V、W形成的10电子氢化物是甲烷、氨气和水。由于水分子间存在氢键,所以水的沸点最高,较低是甲烷和氨气。燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以热化学方程式是CH4(g) +2O2(g)=CO2(g)+2H2O(l) △H=-890.31KJ·mol-1。
(4)由于硝酸具有氧化性,能把SO2氧化生成硫酸,而还原产物是NO,反应的离子方程式是3SO2+3Ba2+ +2H2O +2NO3- =3BaSO4↓+2NO↑ + 4H+。在氧化还原反应中还原剂的还原性强于还原产物的,所以还原性较强的是SO2。
(1)氮气中含有氮氮三键,所以气结构式是N≡N;XW是氧化镁,氧化镁是含有离子键的离子化合物,电子式为
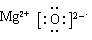 。S元素的原子序数是16,位于第三周期ⅥA族。由于氨水是弱碱,所以氨气极易结合氢离子生成NH4+。
。S元素的原子序数是16,位于第三周期ⅥA族。由于氨水是弱碱,所以氨气极易结合氢离子生成NH4+。(2)在碳元素形成的单质中金刚石是原子晶体,而C60是分子晶体,不存在离子晶体和金属晶体,答案选①③。
(3)U、V、W形成的10电子氢化物是甲烷、氨气和水。由于水分子间存在氢键,所以水的沸点最高,较低是甲烷和氨气。燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以热化学方程式是CH4(g) +2O2(g)=CO2(g)+2H2O(l) △H=-890.31KJ·mol-1。
(4)由于硝酸具有氧化性,能把SO2氧化生成硫酸,而还原产物是NO,反应的离子方程式是3SO2+3Ba2+ +2H2O +2NO3- =3BaSO4↓+2NO↑ + 4H+。在氧化还原反应中还原剂的还原性强于还原产物的,所以还原性较强的是SO2。

练习册系列答案
相关题目

 NF3+3NH4F
NF3+3NH4F
 )具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。
 ,沸点
,沸点 ,在
,在 以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断GE3的晶体类型为________________。
以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断GE3的晶体类型为________________。

 表示)的位置,在大正方体的棱、顶、面等处画出相应Si(用
表示)的位置,在大正方体的棱、顶、面等处画出相应Si(用 表示)的位置。
表示)的位置。