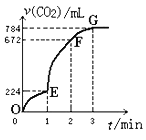
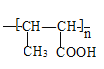题目内容
【题目】写出下列热化学反应方程式:
(1)1mol硫酸和氢氧化钠溶液反应放出114.6kJ热量,写出表示中和热的热化学反应方程式____________。
(2)0.5molC2H5OH(l)完全燃烧放出683.4kJ热量,写出表示C2H5OH燃烧热热化学反应方程式________。
(3)24g碳与适量H2O(g)反应吸收262.6kJ热量_________。
【答案】1/2H2SO4(aq)+NaOH(aq)═1/2Na2SO4(aq)+H2O(l) △H=-57.3kJ/mol C2H5OH(l)+3O2(g)=2CO2(g)+H2O(l) H=-1366.8KJ/mol C(s)+H2O(g)=H2(g)+CO(g) H=+131.5KJ/mol
【解析】
(1)中和热为稀的强酸、碱反应生成1mol液态水时释放的能量;
(2)C2H5OH燃烧热为1mol完全燃烧生成稳定的氧化物时释放的能量;
(3)碳固体与气态水反应生成一氧化碳气体和氢气。
(1)中和热为稀的强酸、碱反应生成1mol液态水时释放的能量,则中和热的方程式为![]() H2SO4(aq)+NaOH(aq)═
H2SO4(aq)+NaOH(aq)═![]() Na2SO4(aq)+H2O(l) △H=-57.3kJ/mol;
Na2SO4(aq)+H2O(l) △H=-57.3kJ/mol;
(2)C2H5OH燃烧热为1mol完全燃烧生成稳定的氧化物时释放的能量,焓变为1366.8kJ/mol,燃烧热的热化学方程式为C2H5OH(l)+3O2(g)=2CO2(g)+H2O(l) H=-1366.8kJ/mol;
(3)碳固体与气态水反应生成一氧化碳气体和氢气,24g碳的物质的量为2mol,则热化学方程式为C(s)+H2O(g)=H2(g)+CO(g) H=+131.5kJ/mol。

 阅读快车系列答案
阅读快车系列答案【题目】(15分)含碳物质的价值型转化,有利于“减碳”和可持续性发展,有着重要的研究价值。请回答下列问题:
(1)已知CO分子中化学键为C≡O。相关的化学键键能数据如下:
化学键 | H—O | C≡O | C=O | H—H |
E/(kJ·mol1) | 463 | 1075 | 803 | 436 |
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=___________kJ·mol1。下列有利于提高CO平衡转化率的措施有_______________(填标号)。
CO2(g)+H2(g) ΔH=___________kJ·mol1。下列有利于提高CO平衡转化率的措施有_______________(填标号)。
a.增大压强 b.降低温度
c.提高原料气中H2O的比例 d.使用高效催化剂
(2)用惰性电极电解KHCO3溶液,可将空气中的CO2转化为甲酸根(HCOO),然后进一步可以制得重要有机化工原料甲酸。CO2发生反应的电极反应式为________________,若电解过程中转移1 mol电子,阳极生成气体的体积(标准状况)为_________L。
(3)乙苯催化脱氢制取苯乙烯的反应为:![]() (g)+CO2(g)
(g)+CO2(g)![]()
![]() (g)+CO(g)+H2O(g),其反应历程如下:
(g)+CO(g)+H2O(g),其反应历程如下:
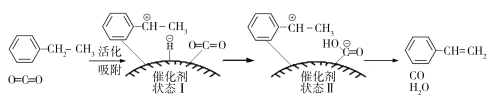
①由原料到状态Ⅰ____________能量(填“放出”或“吸收”)。
②一定温度下,向恒容密闭容器中充入2 mol乙苯和2 mol CO2,起始压强为p0,平衡时容器内气体总物质的量为5 mol,乙苯的转化率为_______,用平衡分压代替平衡浓度表示的化学平衡常数Kp=_______。[气体分压(p分)=气体总压(p总)×气体体积分数]
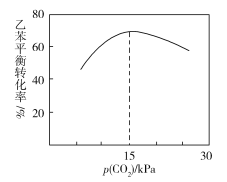
③乙苯平衡转化率与p(CO2)的关系如下图所示,请解释乙苯平衡转化率随着p(CO2)变化而变化的原因________________________________________________。