题目内容
将Mg、Cu组成的2.64g混合物投入到100mL稀硝酸中完全溶解,并收集还原产物NO气体(还原产物只有一种).然后向反应后的溶液中逐滴加入2mol?L-1NaOH溶液,下图是生成沉淀的质量与滴入NaOH溶液体积间的关系图.以下说法不正确的是( )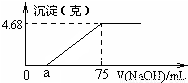
A.稀硝酸的浓度为1.9 mol/L
B.生成的NO在标况下的体积为0.896 L
C.a的值为15 mL
D.Cu的物质的量为0.02 mol
【答案】分析:由图可知,滴加氢氧化钠溶液,开始没有沉淀生成,故硝酸有剩余,加入75mL氢氧化钠溶液,沉淀为最大值,此时溶液中溶质为NaNO3,沉淀的质量为4.68g,故沉淀含有氢氧根离子的质量为4.68g-2.64g=2.04g,物质的量为0.12mol,根据电荷守恒可知,金属提供的物质的量为0.12mol,根据电子转移守恒可知,生成NO的物质的量为 =0.04mol,令金属中Mg的物质的量为xmol,Cu的物质的量为ymol,根据二者质量之和与提供的电子可知,
=0.04mol,令金属中Mg的物质的量为xmol,Cu的物质的量为ymol,根据二者质量之和与提供的电子可知,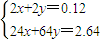 ,故x=0.03mol,y=0.03mol,
,故x=0.03mol,y=0.03mol,
A、原硝酸的物质的量为n(NaNO3)+n(NO)之和,根据c= 计算;
计算;
B、根据V=nVm计算生成NO体积;
C、根据Cu、Mg的物质的量可知,铜离子、镁离子消耗的氢氧根离子的物质的量,进而计算消耗的氢氧化钠的体积,沉淀量最大时消耗的体积减去铜离子、镁离子消耗的氢氧化钠的体积为a的值;
D、根据方程式计算可得Cu的物质的量.
解答:解:由图可知,滴加氢氧化钠溶液,开始没有沉淀生成,故硝酸有剩余,加入75mL氢氧化钠溶液,沉淀为最大值,此时溶液中溶质为NaNO3,沉淀的质量为4.68g,故沉淀含有氢氧根离子的质量为4.68g-2.64g=2.04g,物质的量为0.12mol,根据电荷守恒可知,金属提供的物质的量为0.12mol,根据电子转移守恒可知,生成NO的物质的量为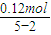 =0.04mol,令金属中Mg的物质的量为xmol,Cu的物质的量为ymol,根据二者质量之和与提供的电子可知,
=0.04mol,令金属中Mg的物质的量为xmol,Cu的物质的量为ymol,根据二者质量之和与提供的电子可知,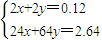 ,故x=0.03mol,y=0.03mol,
,故x=0.03mol,y=0.03mol,
A、原硝酸的物质的量为n(NaNO3)+n(NO)=n(NaOH)+n(NO)=0.075L×2mol?L-1+0.04mol=0.15mol,故原硝酸的物质的量浓度为 =1.9mol/L,故A正确;
=1.9mol/L,故A正确;
B、生成NO的物质的量为0.04mol,标准状况下体积为0.04mol×22.4L/mol=0.896L,故B正确;
C、金属混合物中Cu、Mg的物质的量都为0.03mol,利用元素守恒可知,铜离子、镁离子消耗的氢氧根离子的物质的量为0.06mol×2=0.12mol,消耗的氢氧化钠的体积为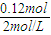 =0.06L=60mL,故a=75-60=15,故C正确;
=0.06L=60mL,故a=75-60=15,故C正确;
D、由上述分析可知,Cu的物质的量为0.03mol,故D错误;
故选D.
点评:以图象形式考查根据方程式的有关计算,清楚图象中反应过程,根据沉淀最大值时判断金属提供的电子是关键,综合考查学生的分析、思维能力.
 =0.04mol,令金属中Mg的物质的量为xmol,Cu的物质的量为ymol,根据二者质量之和与提供的电子可知,
=0.04mol,令金属中Mg的物质的量为xmol,Cu的物质的量为ymol,根据二者质量之和与提供的电子可知,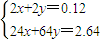 ,故x=0.03mol,y=0.03mol,
,故x=0.03mol,y=0.03mol,A、原硝酸的物质的量为n(NaNO3)+n(NO)之和,根据c=
 计算;
计算;B、根据V=nVm计算生成NO体积;
C、根据Cu、Mg的物质的量可知,铜离子、镁离子消耗的氢氧根离子的物质的量,进而计算消耗的氢氧化钠的体积,沉淀量最大时消耗的体积减去铜离子、镁离子消耗的氢氧化钠的体积为a的值;
D、根据方程式计算可得Cu的物质的量.
解答:解:由图可知,滴加氢氧化钠溶液,开始没有沉淀生成,故硝酸有剩余,加入75mL氢氧化钠溶液,沉淀为最大值,此时溶液中溶质为NaNO3,沉淀的质量为4.68g,故沉淀含有氢氧根离子的质量为4.68g-2.64g=2.04g,物质的量为0.12mol,根据电荷守恒可知,金属提供的物质的量为0.12mol,根据电子转移守恒可知,生成NO的物质的量为
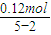 =0.04mol,令金属中Mg的物质的量为xmol,Cu的物质的量为ymol,根据二者质量之和与提供的电子可知,
=0.04mol,令金属中Mg的物质的量为xmol,Cu的物质的量为ymol,根据二者质量之和与提供的电子可知,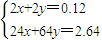 ,故x=0.03mol,y=0.03mol,
,故x=0.03mol,y=0.03mol,A、原硝酸的物质的量为n(NaNO3)+n(NO)=n(NaOH)+n(NO)=0.075L×2mol?L-1+0.04mol=0.15mol,故原硝酸的物质的量浓度为
 =1.9mol/L,故A正确;
=1.9mol/L,故A正确;B、生成NO的物质的量为0.04mol,标准状况下体积为0.04mol×22.4L/mol=0.896L,故B正确;
C、金属混合物中Cu、Mg的物质的量都为0.03mol,利用元素守恒可知,铜离子、镁离子消耗的氢氧根离子的物质的量为0.06mol×2=0.12mol,消耗的氢氧化钠的体积为
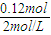 =0.06L=60mL,故a=75-60=15,故C正确;
=0.06L=60mL,故a=75-60=15,故C正确;D、由上述分析可知,Cu的物质的量为0.03mol,故D错误;
故选D.
点评:以图象形式考查根据方程式的有关计算,清楚图象中反应过程,根据沉淀最大值时判断金属提供的电子是关键,综合考查学生的分析、思维能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
将Mg、Cu组成的2.64g混合物投入适量稀稍酸屮恰好完全反应,并收集还原产物 气体NO (还原产物只有一种).然后向反应后的溶液中加入一定浓度的氢氧化钠溶液,使 金属恰好沉淀完全,此时生成沉淀的质量为4.68g,则反应过程中收集到NO气体(标况下气体积为( )
| A、0.448L | B、2.688L | C、0.896L | D、0.224L |
将Mg、Cu组成的2.64 g混合物投入适量稀硝酸中恰好反应,固体完全溶解时收集到还原产物NO气体0.896 L(标准状况),向反应后溶液中加入2 mol·L-1 NaOH溶液60 mL时金属离子恰好沉淀完全。则形成沉淀的物质的量为( )
| A.0.03mol | B.0.06mol | C.0.12mol | D.0.24mol |
 将Mg、Cu组成的2.64g混合物投入到100mL稀硝酸中完全溶解,并收集还原产物NO气体(还原产物只有一种).然后向反应后的溶液中逐滴加入2mol?L-1NaOH溶液,下图是生成沉淀的质量与滴入NaOH溶液体积间的关系图.以下说法不正确的是( )
将Mg、Cu组成的2.64g混合物投入到100mL稀硝酸中完全溶解,并收集还原产物NO气体(还原产物只有一种).然后向反应后的溶液中逐滴加入2mol?L-1NaOH溶液,下图是生成沉淀的质量与滴入NaOH溶液体积间的关系图.以下说法不正确的是( )