题目内容
将Mg、Cu组成的2.64g混合物投入适量稀稍酸屮恰好完全反应,并收集还原产物 气体NO (还原产物只有一种).然后向反应后的溶液中加入一定浓度的氢氧化钠溶液,使 金属恰好沉淀完全,此时生成沉淀的质量为4.68g,则反应过程中收集到NO气体(标况下气体积为( )
| A、0.448L | B、2.688L | C、0.896L | D、0.224L |
分析:Mg、Cu混合物与硝酸反应生成Mg(NO3)2、Cu(NO3)2,部分硝酸被还原为NO气体,反应后的溶液加入NaOH溶液使金属恰好沉淀完全,沉淀为Cu(OH)2、Mg(OH)2,可知m(OH-)=4.68g-2.64g=2.04g,根据电荷守恒可知,金属提供的电子的物质的量等于氢氧根离子的物质的量,根据电子转移守恒计算NO的物质的量,再根据V=nVm计算NO的体积.
解答:解:Mg、Cu混合物与硝酸反应生成Mg(NO3)2、Cu(NO3)2,部分硝酸被还原为NO气体,反应后的溶液加入NaOH溶液使金属恰好沉淀完全,沉淀为Cu(OH)2、Mg(OH)2,可知m(OH-)=4.68g-2.64g=2.04g,故n(OH-)=
=0.12mol,根据电荷守恒可知,金属提供的电子的物质的量等于氢氧根离子的物质的量,即金属提供电子物质的量为0.12mol,根据电子转移守恒可知NO的物质的量=
=0.04mol,故标况下,反应过程中收集到NO气体体积=0.04mol×22.4L/mol=0.896L,
故选C.
| 2.04g |
| 17g/mol |
| 0.12mol |
| 5-2 |
故选C.
点评:本题考查混合物的计算,难度中等,判断金属提供电子等于氢氧根的物质的量是解题关键,注意守恒思想的应用.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
将Mg、Cu组成的2.64 g混合物投入适量稀硝酸中恰好反应,固体完全溶解时收集到还原产物NO气体0.896 L(标准状况),向反应后溶液中加入2 mol·L-1 NaOH溶液60 mL时金属离子恰好沉淀完全。则形成沉淀的物质的量为( )
| A.0.03mol | B.0.06mol | C.0.12mol | D.0.24mol |
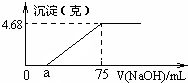 将Mg、Cu组成的2.64g混合物投入到100mL稀硝酸中完全溶解,并收集还原产物NO气体(还原产物只有一种).然后向反应后的溶液中逐滴加入2mol?L-1NaOH溶液,下图是生成沉淀的质量与滴入NaOH溶液体积间的关系图.以下说法不正确的是( )
将Mg、Cu组成的2.64g混合物投入到100mL稀硝酸中完全溶解,并收集还原产物NO气体(还原产物只有一种).然后向反应后的溶液中逐滴加入2mol?L-1NaOH溶液,下图是生成沉淀的质量与滴入NaOH溶液体积间的关系图.以下说法不正确的是( )