题目内容
以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表.
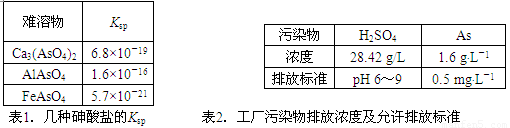
表1.几种砷酸盐的Ksp
表2.工厂污染物排放浓度及允许排放标准
回答以下问题:
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)= mol?L-1.
(2)写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]= ,若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol?L-1,c(AsO43-)的最大是 mol?L-1.
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式 .
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降.
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为 ;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为 .
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 浓度 | 28.42g/L | 1.6g?L-1 |
| 排放标准 | pH 6~9 | 0.5mg?L-1 |
回答以下问题:
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=
(2)写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]=
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降.
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为
分析:(1)依据图表中的硫酸质量浓度换算 物质的量计算得到;
(2)依据难溶物Ca3(AsO4)2的Ksp的概念是沉淀溶解平衡中的两种浓度幂次方乘积;依据Ksp越小,先生成沉淀,依据溶度积常数计算得到两种浓度;
(3)根据反应物和生成物结合元素化合价的变化配平方程式;
(4)①硫酸钙难溶于酸,所以酸性条件下能析出;
②H3AsO4是弱酸电离出来的AsO43-较少,所以酸性条件下不易形成Ca3(AsO4)2沉淀.
(2)依据难溶物Ca3(AsO4)2的Ksp的概念是沉淀溶解平衡中的两种浓度幂次方乘积;依据Ksp越小,先生成沉淀,依据溶度积常数计算得到两种浓度;
(3)根据反应物和生成物结合元素化合价的变化配平方程式;
(4)①硫酸钙难溶于酸,所以酸性条件下能析出;
②H3AsO4是弱酸电离出来的AsO43-较少,所以酸性条件下不易形成Ca3(AsO4)2沉淀.
解答:解:(1)图表中硫酸浓度为28.42g/L,换算物质的量浓度=
=0.29mol/L;
故答案为:0.29;
(2)难溶物Ca3(AsO4)2的沉淀溶解平衡为:Ca3(AsO4)2(s)?3Ca2++2AsO43-;溶度积Ksp=c3(Ca2+)?c2 (AsO43-);若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol?L-1,依据Ksp大小可以得到,Ksp(FeAsO4 )小,反应过程中Fe3+先析出沉淀;依据Ksp(FeAsO4 )=c(Fe3+)c(AsO43-)=5.7×10-21;Fe3+的浓度均为1.0×10-4mol?L-1,计算得到 c(AsO43-)=5.7×10-17mol/L;
故答案为:c3(Ca2+)?c2 (AsO43-);5.7×10-17;
(3)三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),则该反应的离子方程式为:2H++MnO2+H3AsO3=H3AsO4+Mn2++H2O;
故答案为:2H++MnO2+H3AsO3=H3AsO4+Mn2++H2O;
(4)①硫酸钙难溶于酸,所以酸性条件下能析出,因此pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为CaSO4,故答案为:CaSO4;
②H3AsO4是弱酸电离出来的AsO43-较少,所以酸性条件下不易形成Ca3(AsO4)2沉淀,当溶液中pH调节到8左右时AsO43-浓度增大,Ca3(AsO4)2开始沉淀,
故答案为:H3AsO4是弱酸,当溶液中pH调节到8左右时AsO43-浓度增大,Ca3(AsO4)2开始沉淀.
| ||
| 1L |
故答案为:0.29;
(2)难溶物Ca3(AsO4)2的沉淀溶解平衡为:Ca3(AsO4)2(s)?3Ca2++2AsO43-;溶度积Ksp=c3(Ca2+)?c2 (AsO43-);若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol?L-1,依据Ksp大小可以得到,Ksp(FeAsO4 )小,反应过程中Fe3+先析出沉淀;依据Ksp(FeAsO4 )=c(Fe3+)c(AsO43-)=5.7×10-21;Fe3+的浓度均为1.0×10-4mol?L-1,计算得到 c(AsO43-)=5.7×10-17mol/L;
故答案为:c3(Ca2+)?c2 (AsO43-);5.7×10-17;
(3)三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),则该反应的离子方程式为:2H++MnO2+H3AsO3=H3AsO4+Mn2++H2O;
故答案为:2H++MnO2+H3AsO3=H3AsO4+Mn2++H2O;
(4)①硫酸钙难溶于酸,所以酸性条件下能析出,因此pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为CaSO4,故答案为:CaSO4;
②H3AsO4是弱酸电离出来的AsO43-较少,所以酸性条件下不易形成Ca3(AsO4)2沉淀,当溶液中pH调节到8左右时AsO43-浓度增大,Ca3(AsO4)2开始沉淀,
故答案为:H3AsO4是弱酸,当溶液中pH调节到8左右时AsO43-浓度增大,Ca3(AsO4)2开始沉淀.
点评:本题考查了溶液中浓度的换算,沉淀溶解平衡的溶度积常数计算,离子方程式的书写,沉淀的形成等,考查的知识点较多,题目难度中等.

练习册系列答案
 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
(6分)某硫酸厂以硫铁矿为原料生产硫酸,主要过程的化学反应情况如下:
| 生产过程 | 化学反应 | 反应情况 |
| 硫铁矿的燃烧 | 4 +11O2 2Fe2O3+8SO2 2Fe2O3+8SO2 | 4%的硫元素损失而混入炉渣 |
| SO2的接触氧化 | 2SO2+O2 2SO3 2SO3 | SO2转化率为95% |
| SO3的吸收 | SO3+H2O=H2SO4 | SO3的吸收率为98% |
 2Fe2O3+8SO2
2Fe2O3+8SO2(2)该厂现用100吨含硫40%的硫铁矿生产硫酸,可生产98%的浓H2SO4多少吨?(除上述硫的损失外,忽略其它损失)
以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表。
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8× 10-19 10-19 |
| AlAsO4 | 1.6×1 0-16 0-16 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 浓度 | 28.42 g/L | 1.6 g·L-1 |
| 排放标准 | pH 6~9 | 0.5 mg·L-1 |
回答以下问题:
⑴该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)= ▲ mol·L-1。
⑵写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]= ▲ ,若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol·L-1,c(AsO43-)的最大是 ▲ mol·L-1。
⑶工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式 ▲ 。
⑷在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为 ▲ ;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为 ▲ 。
 回答以下问题:
回答以下问题: