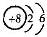题目内容
下列有关表述正确的是( )
(1)-OH与 组成元素相同,含有的电子数也相同 组成元素相同,含有的电子数也相同 | |
| (2)HCN分子的结构式:H-C≡N | |
(3)Br的离子结构示意图: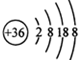 |
(4)CO的分子模型示意图: |
(5)丙烷分子的球形模型: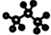 |
(6)次氯酸的电子式为: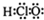 |
(7)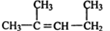 的名称为:1,3-二甲基-2一丁烯 的名称为:1,3-二甲基-2一丁烯 | |
| (8)熔化时NaHSO4的电离方程式为:NaHSO4═Na++HSO4- | |
| A、(1)(2)(4)(6) |
| B、(1)(2)(5)(8) |
| C、(1)(4)(5)(8) |
| D、(2)(3)(5)(7) |
分析:(1)-OH与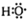 分别为羟基的结构简式和电子式;
分别为羟基的结构简式和电子式;
(2)HCN分子中存在C-H和C≡N;
(3)Br的质子数为35;
(4)CO为直线分子,原子个数为1:1,且原子半径为C>O;
(5)丙烷分子为锯齿型,3个C原子不在一条直线上,球表示原子,棍表示化学键;
(6)次氯酸的结构式为H-O-Cl;
(7)含碳碳双键的最长链为5个碳;
(8)熔化时NaHSO4完全电离,电离出钠离子和硫酸氢根离子.
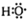 分别为羟基的结构简式和电子式;
分别为羟基的结构简式和电子式;(2)HCN分子中存在C-H和C≡N;
(3)Br的质子数为35;
(4)CO为直线分子,原子个数为1:1,且原子半径为C>O;
(5)丙烷分子为锯齿型,3个C原子不在一条直线上,球表示原子,棍表示化学键;
(6)次氯酸的结构式为H-O-Cl;
(7)含碳碳双键的最长链为5个碳;
(8)熔化时NaHSO4完全电离,电离出钠离子和硫酸氢根离子.
解答:解:(1)-OH与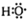 分别为羟基的结构简式和电子式,组成元素相同,含有的电子数也相同,故正确;
分别为羟基的结构简式和电子式,组成元素相同,含有的电子数也相同,故正确;
(2)HCN分子中存在C-H和C≡N,其结构式为H-C≡N,故正确;
(3)Br的质子数为35,其离子的结构示意图为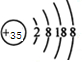 ,故错误;
,故错误;
(4)CO为直线分子,原子个数为1:1,且原子半径为C>O,图中原子个数不符,故错误;
(5)丙烷分子为锯齿型,3个C原子不在一条直线上,球表示原子,棍表示化学键,则丙烷分子的球形模型为 ,故正确;
,故正确;
(6)次氯酸的结构式为H-O-Cl,则其电子式为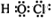 ,故错误;
,故错误;
(7)含碳碳双键的最长链为5个碳,则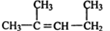 的名称为2-二甲基-2一戊烯,故错误;
的名称为2-二甲基-2一戊烯,故错误;
(8)熔化时NaHSO4完全电离,电离出钠离子和硫酸氢根离子,则电离方程式为NaHSO4═Na++HSO4-,故正确;
故选B.
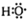 分别为羟基的结构简式和电子式,组成元素相同,含有的电子数也相同,故正确;
分别为羟基的结构简式和电子式,组成元素相同,含有的电子数也相同,故正确;(2)HCN分子中存在C-H和C≡N,其结构式为H-C≡N,故正确;
(3)Br的质子数为35,其离子的结构示意图为
 ,故错误;
,故错误;(4)CO为直线分子,原子个数为1:1,且原子半径为C>O,图中原子个数不符,故错误;
(5)丙烷分子为锯齿型,3个C原子不在一条直线上,球表示原子,棍表示化学键,则丙烷分子的球形模型为
 ,故正确;
,故正确;(6)次氯酸的结构式为H-O-Cl,则其电子式为
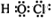 ,故错误;
,故错误;(7)含碳碳双键的最长链为5个碳,则
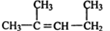 的名称为2-二甲基-2一戊烯,故错误;
的名称为2-二甲基-2一戊烯,故错误;(8)熔化时NaHSO4完全电离,电离出钠离子和硫酸氢根离子,则电离方程式为NaHSO4═Na++HSO4-,故正确;
故选B.
点评:本题考查化学用语,为高频考点,涉及电子式、结构式、结构简式、结构示意图及电离方程式、球棍模型等,综合性较强,注意化学用语的区别及规范应用,题目难度不大,注重基础知识的夯实.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
下列有关表述正确的是( )
| A、H、D、T具有相同的质子数,互为同素异形体 | |||||||||
B、-OH与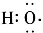 组成元素相同,含有的电子数也相同 组成元素相同,含有的电子数也相同 | |||||||||
C、CH2
| |||||||||
D、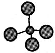 和 和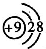 表示的两种粒子均含有某种元素 表示的两种粒子均含有某种元素 |