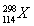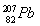题目内容
在碘酸钠(NaIO3)的碱性溶液中通入氯气,可以得到高碘酸钠(Na2H3IO6)。下列有关该反应的说法错误的是 ( )。
A.在该反应中碘酸钠作还原剂
B.碱性条件下,氯气的氧化性强于高碘酸钠的氧化性
C.反应中生成1 mol Na2H3IO6转移2 mol电子
D.反应中氧化产物与还原产物的物质的量之比为2∶1
D
【解析】本题考查氧化还原反应,难度中等。碘酸钠中碘元素的化合价升高,作为还原剂,A选项正确;氯气为氧化剂,高碘酸钠为氧化产物,氧化剂的氧化性强于氧化产物的氧化性,B选项正确;高碘酸钠中碘元素为+7价,则生成1 mol Na2H3IO6,转移2 mol电子,C选项正确;该反应的离子方程式为IO3-+Cl2+3OH-=H3IO62-+2Cl-,氧化产物与还原产物的物质的量之比为1∶2,D选项错误。

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
在KI溶液中存在下列平衡:I2(aq)+I-(aq)=I3-(aq)。测得不同温度下该反应的平衡常数K如表所示:
t/℃ | 5 | 15 | 25 | 35 | 50 |
K | 1 100 | 841 | 689 | 533 | 409 |
下列说法正确的是 ( )。
A.反应I2(aq)+I-(aq)  I3-(aq)的ΔH>0
I3-(aq)的ΔH>0
B.其他条件不变,升高温度,溶液中c(I3-)减小
C.该反应的平衡常数表达式为K=
D.25 ℃时,向溶液中加入少量KI固体,平衡常数K小于689