题目内容
化学在环境保护中起着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1)催化反硝化法中,H2能将NO3-还原为N2。25℃时,反应进行10min,溶液的pH由7变为12。
①N2的结构式为 。
②上述反应的离子方程式为 ,其平均反应速率υ(NO3-)为 mol·L-1min-1。
③还原过程中可生成中间产物NO2-,写出3种促进NO2-水解的方法 。
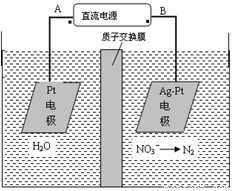
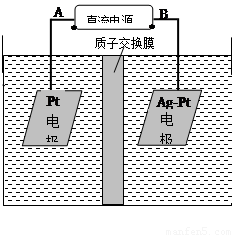
(2)电化学降解NO3-的原理如图所示。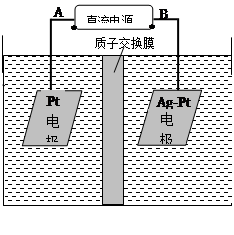
①电源正极为 (填A或B),阴极反应式为 。
②若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为 g。
(14分)
(1)①N≡N
②2NO3?+5H2 N2+2OH?+4H2O ,0.001
N2+2OH?+4H2O ,0.001
③加酸,升高温度,加水
(2)①A ,2NO3?+6H2O+10e?=N2↑+12OH?
②14.4
解析(1)①N2分子含氮氮三键,继而可写出结构式。
②根据题目所给条件,可知反应物为NO3?和H2,产物为N2和2OH?,根据原子守恒可推出还生成水,配平可得出离子方程式;溶液的pH由7变为12,可知生成的C(OH?)=0.01mol?L?1,则V(NO3?)= 0.01mol?L?1÷10min="0.001" mol?L?1?min-1。
③因为水解反应都是吸热反应,NO2-水解生成OH?,根据平衡移动原理,可知加酸,升高温度,加水,可促进NO2-的水解。
(2)①NO2-在阴极得电子生成N2,所以B极为电源的负极,则A极为电源的正极,根据原子守恒和电荷守恒,反应物还有H2O,生成物还有OH?。配平地离子方程式。
②除了电极反应会造成电解液的质量变化,质子通过质子交换膜导电也会产生电解液的质量变化,转移2mol电子,会有2molH+从左侧移动到右侧,使左侧电解液质量减少2g,右侧电解液质量增加2g
左侧电极反应为H2O电离的OH?放电:4OH?-4e?=2H2O+O2↑
4mol 32g
2mol 16g
所以转移2mol电子,左侧电解液共减少:16g+2g=18g
右侧电极反应为:2NO3? + 6H2O + 10e? = N2↑+12OH?
10mol 28g
2mol 5.6g
H+移向右侧,所以转移2mol电子,右侧电解液共减少:5.6g-2g=3.6g
因此两侧电解液的质量变化为:18g-3.6g=14.4g。
【考点定位】本题考查结构式和方程式的书写、反应速率的计算、水解平衡的移动、电极的判断和化学计算。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案化学在环境保护中起着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1) 催化反硝化法中,H2能将NO3—还原为N2,25℃时,反应进行10min,溶液的pH由7变为12。
①N2的结构式为 。
②上述反应离子方程式为 ,其平均反应速率v(NO3—)为 。
|
。
④在NaNO2 溶液中,质子守恒表达式为
___________________________________________。
(2)电化学降解NO3—的原理如右图所示。
| |
阴极反应式为:
。