题目内容
X、Y、Z、W为四种短周期元素,有关这四种元素的说法中一定正确的是( )
| 元素 | X | Y | Z | W |
| 原子半径(nm) | 0.077 | 0.075 | 0.102 | 0.099 |
| 最高正价或最低负价 | +4 | +5 | -2 | -1 |
A.X与W形成XW4时,各原子最外层均满 足8电子稳定结构,
B.1molW的单质参加氧化还原反应时转移的电子数为2mol
C.0.3molCu分别与足量HYO3和H2ZO4的稀溶液反应均产生0.2mol气体
D.Y的氢化物与W的氢化物反应的产物只含有共价键
A
解析试题分析:由表中的原子半径和化合价的数据判定,X、Y的半径小于Z、W,所以X、Y位于第二周期,根据化合价判断X为碳,Y为氮,同理得Z为硫,W为氯。A、碳与氯形成的四氯化碳的各原子最外层均达8电子稳定结构,正确;B、1mol氯气参加反应时未必转移2mol电子,如与水的反应只转移1mol电子,错误;C、铜不与稀硫酸反应,错误;D、氨气与氯化氢的反应产物是氯化铵,不仅含共价键还含有离子键,错误,答案选A。
考点:考查由元素的性质判断元素的位置及相关的知识

练习册系列答案
相关题目
X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示,这四种元素原子的最外层电子数之和为20。下列判断正确的是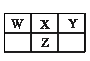
| A.四种元素的原子半径:rZ>rX>rY>rW |
| B.四种元素形成的单质最多有6种 |
| C.四种元素均可与氢元素形成电子总数为18的分子 |
| D.四种元素中,Z的最高价氧化物对应的水化物酸性最强 |
具有下列最外层电子排布的基态原子,其相应的元素一定属于主族的是( )
| A.ns1 | B.ns2 | C.ns2np6 | D.ns2np2 |
下列各组给定原子序数的元素,不能形成原子数之比为1∶1稳定化合物的是
| A.3和17 | B.1和8 | C.11和8 | D.7和12 |
某元素原子仅有的2个价电子填充在n=4,l=0能级上,则该元素的原子序数为( )。
| A.14 | B.19 | C.20 | D.33 |
有人建议将氢元素排在元素周期表的ⅦA族。下列事实能支持这一观点的是( )。
①H原子得到一个电子实现最外电子层稳定结构;
②氢分子的结构式为H—H;
③与碱金属元素形成离子化合物:M+[:H]-
④分子中原子间的化学键都属于非极性键
| A.①②③ | B.①③④ | C.②③④ | D.①②③④ |
X、Y、R、M均为短周期元素,X、Y同周期,X、Y两种元素最高价氧化物对应水化物化学式分别为H2XO4和HYO4。R、M同主族,R与冷水即可反应,M与热水反应缓慢。下列关系正确的是 ( )。
| A.原子半径X>Y | B.氢化物稳定性H2X>HY |
| C.原子核内质子数R<M | D.溶液碱性R(OH)2<M(OH)2 |
镁、锂在元素周期表中具有特殊“对角线”关系,它们的性质相似。例如,它们的单质在过量氧气中燃烧时均只生成正常的氧化物等,下列关于锂的叙述不正确的是( )
| A.Li2SO4能溶于水 |
| B.LiOH是易溶于水、受热不分解的强碱 |
| C.Li遇浓硫酸不产生“钝化”现象 |
| D.Li2CO3受热分解,生成Li2O和CO2 |