题目内容
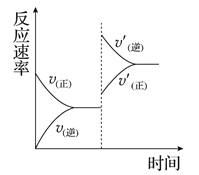
【题目】在密闭容器中发生反应2SO2(g) + O2(g) ![]() 2SO3(g);△H<0。下图是该反应化学反应速率随时间变化的图像,推断在t1时刻突然变化的条件可能是
2SO3(g);△H<0。下图是该反应化学反应速率随时间变化的图像,推断在t1时刻突然变化的条件可能是

A. 催化剂失效 B. 增大容器的体积
C. 降低体系温度 D. 减小生成物的浓度
【答案】C
【解析】
分析图象可知,0~t1时间段是建立平衡的过程,t1时反应处于平衡状态,t1时改变条件后正、逆反应速率都减小,因为正反应速率大于逆反应速率,所以平衡向正反应方向移动,结合温度、压强、浓度、催化剂对反应速率和平衡的影响来分析。
A.由图象可知t1改变条件后正反应速率大于逆反应速率,说明该反应向正反应方向移动,但催化剂不能使平衡移动,与图象不符,A项错误;
B.增大容器的体积时反应物和生成物浓度都减小,正反应速率和逆反应速率都要减小,增大容器的体积即减小压强,根据平衡移动原理可知减压使该平衡向逆反应方向移动,则逆反应速率大于正反应速率,与图象不符,B项错误;
C.降低体系温度时正反应速率和逆反应速率都减小,根据平衡移动原理可知降温使该平衡向正反应方向移动,则正反应速率大于逆反应速率,与图象相符,C项正确;
D.在减小生成物浓度的瞬间逆反应速率减小,而正反应速率不变,与图象不相符,D项错误;答案选C。

练习册系列答案
相关题目