题目内容
【题目】[化学—选修3:物质结构与性质]碳及其化合物广泛存在于自然界中,回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用 形象化描述。
(2)碳在形成化合物时,其键型以共价键为主,原因是 。
(3)C2H2 分子中,共价键的类型有 ,C 原子的杂化轨道类型是 ,写出两个与C2H2具有相同空间构型含碳无机物分子的分子式 。
( 4 )CO 能与金属Fe、Ni分别形成Fe(CO)5、Ni(CO)4,Fe(CO)5中Fe元素的原子核外电子排布为 ,Ni(CO)4是无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂推测Ni(CO)4是 晶体。
(5)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
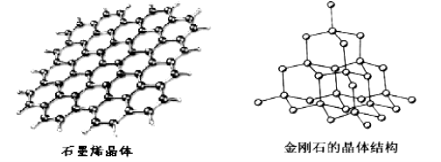
①石墨烯晶体中,每个C 原子连接 个六元环,每个六元环占有 个C 原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接 个六元环,六元环中最多有 个C原子在同一平面。
【答案】(1)电子云
(2)C有4个价电子且半径较小,难以通过得或失电子达到稳定结构
(3)σ键、π键 sp CO2、CS2、HCN或COS等
(4)1s22s22p63s23p63d64s2(或[Ar]3d64s2) 分子
(5)① 3 2 ② 12 4
【解析】
试题分析:(1)电子在原子核外出现的概率密度分布可用电子云描述;(2)C有4个价电子且半径较小,难以通过得或失电子达到稳定结构,所以碳在形成化合物时,其键型以共价键为主;(3)C2H2 分子的结构式为![]() ,共价键的类型有σ键、π键;乙炔为直线型分子,C 原子的杂化轨道类型是sp;CO2、CS2都是直线型;( 4 )CO 能与金属Fe、Ni分别形成Fe(CO)5、Ni(CO)4,Fe(CO)5中Fe元素的原子核外电子排布1s22s22p63s23p63d64s2(或[Ar]3d64s2);Ni(CO)4,熔沸点低,推测Ni(CO)4是分子晶体。(5)①根据图示,石墨烯晶体中,每个C 原子连接3个六元环;根据均摊法,每个六元环占有
,共价键的类型有σ键、π键;乙炔为直线型分子,C 原子的杂化轨道类型是sp;CO2、CS2都是直线型;( 4 )CO 能与金属Fe、Ni分别形成Fe(CO)5、Ni(CO)4,Fe(CO)5中Fe元素的原子核外电子排布1s22s22p63s23p63d64s2(或[Ar]3d64s2);Ni(CO)4,熔沸点低,推测Ni(CO)4是分子晶体。(5)①根据图示,石墨烯晶体中,每个C 原子连接3个六元环;根据均摊法,每个六元环占有![]() =2个C 原子;②根据图示,在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接12个六元环,六元环中最多有4个C原子在同一平面。
=2个C 原子;②根据图示,在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接12个六元环,六元环中最多有4个C原子在同一平面。