题目内容
【题目】Ⅰ.氯酸钾和浓盐酸之间有下列反应:2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O.
(1)该反应中发生还原反应的物质是________。氧化产物是________。
(2)用双线桥标出方程式中的电子得失2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O________。
(3)当有0.2 mol电子发生转移时,生成的氯气的体积为________L (标准状况)。被氧化的HCl的物质的量为________mol.
(4)若分别用①KMnO4(还原产物是Mn2+)②MnO2(还原产物是Mn2+) ③Ca(ClO)2(还原产物是Cl2)氧化浓盐酸制备氯气,当浓盐酸足量且这三种氧化剂的物质的量相同时,生成氯气的物质的量最少的是________。
Ⅱ.检测人的血液中葡萄糖(简称血糖,相对分子质量为180)含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1 L=l0dL)。以“mmol/L”表示时,人的血糖正常值在3.6~6.0 mmol/L之间。如果以“mg/dL”表示,血糖正常值范围是________。
【答案】KClO3 Cl2 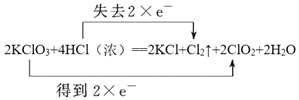 2.24 0.2 ② 64.8~108.0 mg/dL
2.24 0.2 ② 64.8~108.0 mg/dL
【解析】
Ⅰ.(1)依据氧化还原反应的规律作答;
(2)KClO3转化为ClO2转移电子数为2![]() e-,HCl中Cl元素化合价升高,失去电子数为2
e-,HCl中Cl元素化合价升高,失去电子数为2![]() e-,据此利用双线桥法分析;
e-,据此利用双线桥法分析;
(3)当有0.2mol电子发生转移时,生成的氯气是0.1mol;
(4)利用假设法,根据电子守恒分析作答;
Ⅱ. 1mmol=10-3mol,1g=103mg,1L=10dL;根据上述单位的转化关系将已知的正常血糖范围3.6~6.0 mmol/L转化为以“mg/dL”为单位的数据。
Ⅰ.(1)氯酸钾中氯元素化合价从+5价降低到+4价,得到1个电子,因此该反应中发生还原反应的物质是KClO3。氯化氢中氯元素化合价从-1价升高到0价,失去电子,则氧化产物是Cl2;
(2)根据以上分析可知用双线桥标出方程式中的电子得失为 ;
;
(3)当有0.2mol电子发生转移时,生成的氯气是0.1mol,在标准状况下的体积为2.24L;根据氯原子守恒可知被氧化的HCl的物质的量为0.2mol;
(4)假设均是1mol氧化剂参加反应,根据电子得失守恒可知1mol高锰酸钾得到氯气的物质的量是2.5mol,1mol二氧化锰得到氯气的物质的量是1mol,根据方程式Ca(ClO)2+4HCl=2Cl2↑+CaCl2+2H2O可知1mol次氯酸钙得到2mol氯气,所以生成氯气的物质的量最少的是二氧化锰,答案选②;
Ⅱ. 1mmol=10-3mol,1g=103mg,1L=10dL,1L中3.6mmol血糖的质量为:3.6×10-3mol×180×103mg/mol=648mg,用“mg/dL”表示血糖的浓度为:![]() =64.8 mg/dL;6.0 mmol血糖的质量为:6.0×10-3mol×180×103mg/mol=1080 mg,用“mg/dL”表示血糖的浓度为:
=64.8 mg/dL;6.0 mmol血糖的质量为:6.0×10-3mol×180×103mg/mol=1080 mg,用“mg/dL”表示血糖的浓度为:![]() =108.0 mg/dL,故以“mg/dL”表示血糖的正常值范围是:64.8~108.0 mg/dL之间,故答案为:64.8~108.0 mg/dL。
=108.0 mg/dL,故以“mg/dL”表示血糖的正常值范围是:64.8~108.0 mg/dL之间,故答案为:64.8~108.0 mg/dL。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案