题目内容
(10分)甲苯与干燥氯气在光照下反应生成氯化苄,用下列方法分析粗产品的纯度:称取0.255g样品,与25 mL 4mol?L-1氢氧化钠水溶液在100 mL圆底烧瓶中混合,加热回流1小时;冷至室温,加入50 mL20%硝酸后,用25.00mL 0.1000mol?L-1硝酸银水溶液处理,再用0.1000mol?L-1NH4SCN水溶液滴定剩余的硝酸银,以硫酸铁铵为指示剂,消耗了6.75 mL。
5-1 写出分析过程的反应方程式。
5-2 计算样品中氯化苄的质量分数(%)。
5-3 通常,上述测定结果高于样品中氯化苄的实际含量,指出原因。
5-4 上述分析方法是否适用于氯苯的纯度分析?请说明理由。
5-1(4 分)C6H5CH2Cl+NaOH =C6H5CH2OH +NaCl
NaOH+HNO3=NaNO3+H2O (此式不计分 )
AgNO3+NaCl=AgCl↓+NaNO3
NH4SCN+AgNO3=AgSCN↓+NH4NO3
Fe3++SCN-=Fe(SCN)2+
每式 1 分;写出正确的离子方程式也得满分;最后一个反应式写成 Fe3++3SCN-=Fe(SCN)3也可。
5-2(2 分)样品中氯化苄的摩尔数等于 AgNO3溶液中 Ag+的摩尔数与滴定所消耗的 NH4SCN 的摩尔数的差值,因而,样品中氯化苄的质量分数为
M (C6H5CH2Cl)×[0.1000×(25.00-6.75)]/255
={126.6×[0.1000×(25.00-6.75)]/255} × 100% = 91%
算式和结果各 1 分; 若答案为 90.6%,得 1.5 分(91%相当于三位有效数字,90.6%相当于四位有效数字)。
5-3(2 分)测定结果偏高的原因是在甲苯与 Cl2反应生成氯化苄的过程中,可能生成少量的多氯代物 C6H5CHCl2和C6H5CCl3,反应物 Cl2及另一个产物 HCl 在氯化苄中也有一定的溶解,这些杂质在与 NaOH 反应中均可以产生氯离子,从而导致测定结果偏高。
凡答出由以下情况导致测定结果偏高的均得满分:1)多氯代物、Cl2和HCl;2)多氯代物和 Cl2;3)多氯代物和 HCl;4)多氯代物。凡答出以上任何一种情况,但又提到甲苯的,只得 1 分。若只答 Cl2和/或 HCl 的,只得 1 分。
5-4(2 分)不适用。(1 分)氯苯中,Cl 原子与苯环共轭,结合紧密,难以被 OH−交换下来。(1 分)
氯苯与碱性水溶液的反应须在非常苛刻的条件下进行,而且氯苯的水解也是非定量的。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案(12分)(1)阿司匹林是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程(略)。
①写出制备阿司匹林的化学方程式 。
可用重结晶提纯法提纯阿司匹林。方法如下:
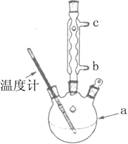
加热回流的装置如图所示:
②使用温度计的目的是 。
③冷凝水的流进方向是 。(填“b”或“c”)。
④重结晶提纯法所得产品的有机杂质较少的原因 。
检验产品中是否含有水杨酸的化学方法是 。
(2)氯化苄(C6H5CH2Cl)也是一种重要的有机化工原料。工业上采用甲苯与干燥氯气在光照条件下反应合成氯化苄。为探索不同光强条件对合成产率的影响,需要对不同光强条件下的粗产品(含甲苯)进行纯度检测。每一组检测按照如下步骤进行:
| A.称取0.300 g样品。 |
| B.将样品与25 mL 4 mol·L-lNaOH溶液在三颈烧瓶中混合,水浴加热回流l小时后停止加热(发生的反应为:C6H5CH2Cl+NaOH→C6H5CH2OH+ NaCl)。 |
| C.在三颈烧瓶中加入50 mL 2 mol·L-l HNO3,混合均匀。 |
| D.将三颈烧瓶中溶液全部转移到100 mL容量瓶中,加水定容。 |
F.在锥形瓶中滴入几滴NH4Fe(SO4)2溶液作为指示剂,用0.0250 mol·L-1 NH4SCN溶液滴定剩余的AgNO3。
G.重复E、F步骤三次,消耗0.0250 mol·L1NH4SCN溶液的平均值为4.00mL。
(已知:NH4SCN+ AgNO3= AgSCN↓+NH4NO3)根据以上实验信息回答下列相关问题:
①C步骤所加硝酸的目的是 。
②在F步骤操作中,判断达到滴定终点的现象是 。
③该产品的纯度为 。(请保留2位小数)
 (2011?杭州一模)氯化苄(C6H5CH2Cl)是一种重要的有机化工原料,广泛应用于医药、染料、助香料等有机化工产品的制备.氯化苄为无色液体,具有强烈的催泪作用,沸点为179.4℃,不溶于水,可混溶于乙醇、氯仿等多数有机溶剂.工业上采用甲苯与干燥氯气在光照条件下反应合成氯化苄.为探索不同光强条件对合成产率的影响,需要对不同光强条件下的粗产品进行纯度检测.每一组检测按照如下步骤进行:
(2011?杭州一模)氯化苄(C6H5CH2Cl)是一种重要的有机化工原料,广泛应用于医药、染料、助香料等有机化工产品的制备.氯化苄为无色液体,具有强烈的催泪作用,沸点为179.4℃,不溶于水,可混溶于乙醇、氯仿等多数有机溶剂.工业上采用甲苯与干燥氯气在光照条件下反应合成氯化苄.为探索不同光强条件对合成产率的影响,需要对不同光强条件下的粗产品进行纯度检测.每一组检测按照如下步骤进行:
 氯化苄(C6H5CH2Cl)是一种重要的有机化工原料,广泛应用于医药、染料、助香料等有机化工产品的制备.氯化苄为无色液体,具有强烈的催泪作用,沸点为179.4℃,不溶于水,可混溶于乙醇、氯仿等多数有机溶剂.工业上采用甲苯与干燥氯气在光照条件下反应合成氯化苄.为探索不同光强条件对合成产率的影响,需要对不同光强条件下的粗产品进行纯度检测.每一组检测按照如下步骤进行:
氯化苄(C6H5CH2Cl)是一种重要的有机化工原料,广泛应用于医药、染料、助香料等有机化工产品的制备.氯化苄为无色液体,具有强烈的催泪作用,沸点为179.4℃,不溶于水,可混溶于乙醇、氯仿等多数有机溶剂.工业上采用甲苯与干燥氯气在光照条件下反应合成氯化苄.为探索不同光强条件对合成产率的影响,需要对不同光强条件下的粗产品进行纯度检测.每一组检测按照如下步骤进行: