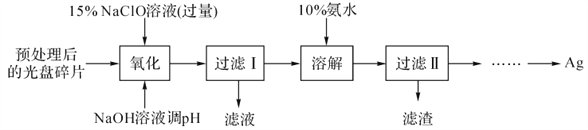
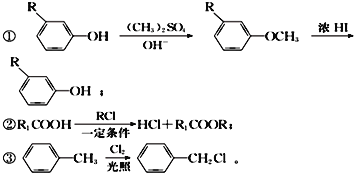
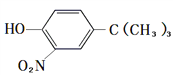
题目内容
【题目】下列离子方程式与所述事实相符且正确的是( )
A. 向明矾溶液中加入过量的氢氧化钡溶液:Al3++2 SO42-+2Ba2++4OH-![]() 2BaSO4↓+ AlO2-+2H2O
2BaSO4↓+ AlO2-+2H2O
B. 稀HNO3 与难溶于水的FeS固体反应:FeS+2H+![]() Fe2++H2S↑
Fe2++H2S↑
C. 向氯化钙溶液中通入CO2气体:Ca2++CO2+H2O![]() CaCO3↓+2H+
CaCO3↓+2H+
D. 强碱溶液中次氯酸钠与Fe(OH)3反应:3ClO-+2Fe(OH)3![]() 2 FeO42-+3Cl-+H2O+4H+
2 FeO42-+3Cl-+H2O+4H+
【答案】A
【解析】A、向明矾溶液中加入过量的氢氧化钡溶液生成硫酸钡、偏铝酸钾和水:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O,A正确;B、硝酸是氧化性酸,稀HNO3与难溶于水的FeS固体反应是发生氧化还原反应,得不到硝酸亚铁和H2S,B错误;C、向氯化钙溶液中通入CO2气体不反应,C错误;D、强碱溶液中次氯酸钠与Fe(OH)3反应:3ClO-+4OH-+2Fe(OH)3=2FeO42-+3Cl-+5H2O,D错误,答案选A。

【题目】NO是一种性质活泼的大气污染物,它能与很多物质发生反应。
Ⅰ、在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2 (g)体系中,n(NO)随时间的变化如表:
2NO2 (g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=_____。已知:![]() >
>![]() ,则该反应是___热反应。
,则该反应是___热反应。
(2)下图中表示NO2的变化的曲线是___________。用O2表示从0-2 s内该反应的平均速率
v =___________。

(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
Ⅱ、超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO![]() 2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
c(CO)(mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)上述条件下反应能够自发进行,则该反应的△H_____0(填写“>”、“<”、“=”)。
(2)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是________。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(3)某同学设计了三组实验,实验条件已经填在下面实验设计表中,分析表格我们可以看出该同学的实验目的主要是研究_______________和_____________________对化学反应速率的影响。
实验编号 | T(℃) | NO初始浓(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
【题目】25℃时,几种弱酸的电离平衡常数如下表所示,下列说法正确的是
化学式 | HCOOH | H2CO3 | HCN |
电离平衡常数 | K=1.8×10-4 | K1=4.3×10-7 K2=5.6×10-11 | K=4.9×10-10 |
A. 酸性强弱顺序是HCOOH>HCN> H2CO3
B. HCOOH的电离平衡常数表达式为
C. Na2CO3溶液显碱性,NaHCO3溶液显酸性
D. H2CO3溶液和NaCN溶液反应的离子方程式为H2CO3+CN-=HCO3-+HCN