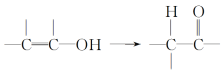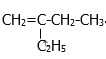题目内容
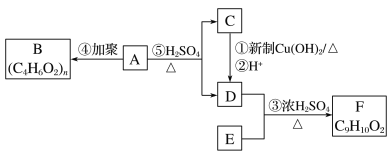
【题目】合成药物异搏定路线中的某一步骤如下:

下列说法正确的是( )
A.Z可以发生取代、加成、氧化、加聚反应
B.1molY最多能与1molNaOH发生反应
C.X中所有原子可能在同一平面内
D.1molZ最多能与6molH2发生反应
【答案】A
【解析】
A.Z中含有苯环,可以与液溴发生取代反应,碳碳双键和苯环均可与H2发生加成反应,含有碳碳双键可以发生加聚反应和氧化反应,A正确;
B.卤素原子可与NaOH反应,酯基可与NaOH反应,则1molY最多能与2molNaOH发生反应,B错误;
C.X中含有-CH3,其空间结构类似于CH4,所有原子不可能共平面,C错误;
D.1molZ中含有的苯环可与3molH2发生加成,1molZ含有2mol碳碳双键可与2molH2发生加成,则1molZ最多与5molH2发生反应,D错误。
答案选A。

 阅读快车系列答案
阅读快车系列答案【题目】I、(1)普通锌锰干电池的结构如图所示。回答下列问题。

①电池中电解质溶液为________。
②负极反应式为______________________________________。
③放电时NH![]() 向________(填“正极”或“负极”)移动。
向________(填“正极”或“负极”)移动。
(2)废电池中的锌皮常用于实验室制氢气,废锌皮和纯锌粒分别与同浓度的稀硫酸反应,产生氢气速率较大的是________,若用过量的纯锌粒与一定量的稀硫酸反应,为了加快反应速率又不影响产生氢气的量,下列措施可行的是________(填序号)。
A.微热 B.加入适量氧化铜 C.加入少量硫酸铜溶液
D.加水 E.加入少量氢氧化钡溶液
II、一定条件下,H2O2在水溶液中发生分解反应:2H2O2![]() 2H2O+O2↑,反应过程中,测得不同时间H2O2的物质的量浓度如下表:
2H2O+O2↑,反应过程中,测得不同时间H2O2的物质的量浓度如下表:
t/min | 0 | 20 | 40 | 60 | 80 |
c(H2O2)/(mol/L) | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
(1)H2O2的分解反应________氧化还原反应(填“是”或“不是”)。
(2)该分解反应0~20 min的平均反应速率v(H2O2)为________ mol/(L·min)。
(3) 加入0.1 mol的MnO2粉末于50 mL过氧化氢的溶液中(密度为1.1 g/mL),在标准状况下放出气体的体积和时间的关系如图所示,反应放出![]() 气体所需要的时间为________;A、B、C、D四点化学反应速率快慢的顺序为________。
气体所需要的时间为________;A、B、C、D四点化学反应速率快慢的顺序为________。

(4)由合成气(组成为H2、CO、和少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应:
甲醇合成反应:①CO(g)+ 2H2(g)=CH3OH(g) ΔH1=-90.1 kJ·mol-1
②CO2(g)+ 3H2(g)=CH3OH(g)+H2O(g) ΔH2=-49.0 kJ·mol-1
水煤气变换反应:③CO(g) + H2O (g)=CO2(g)+H2(g) ΔH3=-41.1 kJ·mol-1
二甲醚合成反应:
由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为________________