题目内容
 工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等.
工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等.(1)①.火箭常用N2H4作燃料,N2O4作氧化剂.1mol联氨完全反应转移
4
4
mol电子②.已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ/mol
NO2(g)?1/2N2O4(g)△H=-26.35kJ/mol
试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:
2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-108 kJ/mol
2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-108 kJ/mol
.(2)联氨--空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的氢氧化钾溶液.写出该电池正极的电极反应式
O2+4e-+2H2O=4OH-
O2+4e-+2H2O=4OH-
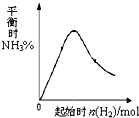
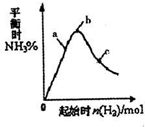
.(3)在300℃时,改变起始反应物中氢气的物质的量对反应.N2(g)+3H2(g)?2NH3(g)△H<0的影响如图所示.请在图中画出400℃时对应的图象.
分析:(1)①依据反应的化学方程式中元素化合价变化计算电子转移;
②依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(2)依据原电池原理分析,碱性溶液中,氧气在正极上得到电子生成氢氧根离子发生还原反应;
(3)合成氨的反应是放热反应,升高温度平衡逆向进行,氨气的含量减小,增大氢气量平衡正向进行,开始氨气含量增大,当氢气量增大到一定程度,氢气增加为主要因素时,氨气含量会减小.
②依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(2)依据原电池原理分析,碱性溶液中,氧气在正极上得到电子生成氢氧根离子发生还原反应;
(3)合成氨的反应是放热反应,升高温度平衡逆向进行,氨气的含量减小,增大氢气量平衡正向进行,开始氨气含量增大,当氢气量增大到一定程度,氢气增加为主要因素时,氨气含量会减小.
解答:解:(1)①火箭常用N2H4作燃料,N2O4作氧化剂,反应的化学方程式为:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g),反应中2mol联氨反应转移电子8mol,所以1mol联氨完全反应转移4mol,
故答案为:4;
②已知①N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ/mol
③NO2(g)?1/2N2O4(g)△H=-26.35kJ/mol
由盖斯定律①+②-③×2得到:热化学方程式:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-108 kJ/mol,
故答案为:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-108 kJ/mol;
(2)联氨--空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的氢氧化钾溶液,燃料电池中燃料在负极失电子发生氧化反应生成氮气,氧气在正极得到电子发生还原反应,正极的电极反应式:O2+4e-+2H2O=4OH-,故答案为:O2+4e-+2H2O=4OH-;
(3)反应N2(g)+3H2(g)?2NH3(g)△H<0,反应是放热反应,升高温度,反应速率增大,平衡逆向进行,氨气的含量减小,随氢气量的增大,平衡移动为主,氨气含量增大,随氢气量增多,当氢气量增大为主时,氨气含量会减小,据此画出400℃时对应的图象为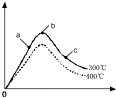 ,故答案为:
,故答案为: .
.
故答案为:4;
②已知①N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ/mol
③NO2(g)?1/2N2O4(g)△H=-26.35kJ/mol
由盖斯定律①+②-③×2得到:热化学方程式:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-108 kJ/mol,
故答案为:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-108 kJ/mol;
(2)联氨--空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的氢氧化钾溶液,燃料电池中燃料在负极失电子发生氧化反应生成氮气,氧气在正极得到电子发生还原反应,正极的电极反应式:O2+4e-+2H2O=4OH-,故答案为:O2+4e-+2H2O=4OH-;
(3)反应N2(g)+3H2(g)?2NH3(g)△H<0,反应是放热反应,升高温度,反应速率增大,平衡逆向进行,氨气的含量减小,随氢气量的增大,平衡移动为主,氨气含量增大,随氢气量增多,当氢气量增大为主时,氨气含量会减小,据此画出400℃时对应的图象为
 ,故答案为:
,故答案为: .
.点评:本题考查了热化学方程式书写和盖斯定律的计算应用,原电池原理的分析,化学平衡移动原理的应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
下列应用不涉及氧化还原反应的是( )
| A、工业上利用N2和H2合成氨,实现人工固氮 | B、实验室用NH4Cl和Ca(0H)2制备NH3 | C、用FeCl3溶液作为“腐蚀液”刻蚀电路铜板 | D、用Na2O2作潜水艇的供氧剂 |
 工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等.
工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等.