题目内容
将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含 NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500mL2mol/LNaOH溶液完全吸收,生成的盐溶液中NaNO3的物质的量为(已知:2NO2+2NaOH=NaNO3+NaNO2+H2O;NO+NO2+2NaOH=2NaNO2+H2O)( )
| A.0.2mol | B.0.4mol | C.0.6mol | D.0.8mol |
A
解析试题分析:所有的氮的氧化物全部被500mL2mol/LNaOH溶液完全吸收,表明两者都无剩余,根椐题中所提供的方程式可知,全部转化成了NaNO3和NaNO2;在这二个产物中,钠元素与氮元素的物质的量是相等的,也就是说,在这个题中,氮的氧化物所提供的氮元素与氢氧化钠所提供的钠元素是等同的,都为1mol,那么,氮的氧化物中的四氧化二氮气体的物质的量就一定为0.2mol,因此生成硝酸钠的反应中就是0.2mol的四氧化二氮了,由2NO2+2NaOH=NaNO3+NaNO2+H2O可知,生成的硝酸钠为0.2mol。选A。
考点:考查原子守恒。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案实验室中需要配制2 mol/L的NaCl溶液950 mL,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是
| A.950 mL 111.2 g | B.500 mL 117 g |
| C.1000 mL 117 g | D.任意规格 111.2 g |
设NA为阿伏加德罗常数的数值,下列叙述正确的是
| A.1 mol/L氯化铜溶液中的Cu2+数小于NA |
| B.标准状况下,22.4 L Cl2与水反应转移的电子数为NA |
| C.28 g聚乙烯含有的碳原子数为2NA |
| D.惰性电极电解食盐水,若线路中通过1NA电子电量,则阳极产生气体11.2L |
下列有关化学用语表示正确的是
A.N2的电子式: |
B.S2-的结构示意图: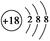 |
C.质子数为53,中子数为78的碘原子: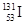 |
| D.乙烯的分子式: CH2=CH2 |
下列有关化学用语表示正确的是
A.中子数为20的氯原子,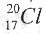 |
B.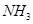 分子的电子式: 分子的电子式: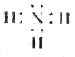 |
C.铝离子结构示意图: |
D.比例模型 表示甲烷分子或四氯化碳分子 表示甲烷分子或四氯化碳分子 |
下列化学用语正确的是
A.NH4Cl的电子式: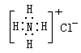 |
B.S2—的结构示意图: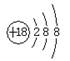 |
| C.乙醇的分子式:CH3CH2OH |
D.原子核内有8个中子的碳原子: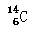 |
向体积均为10 mL且物质的量浓度相同的两份NaOH溶液中分别通入一定量的CO2得到溶液
甲和乙;向甲、乙两溶液中分别滴加0.1mol·L-1盐酸,此时反应生成CO2体积(标准状况) 与所加盐酸体积间的关系如图所示。则下列叙述中正确的是( )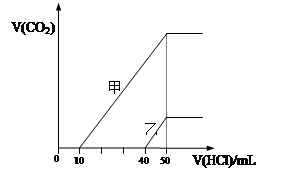
| A.原NaOH溶液的物质的量浓度为0.5 mol·L-1 |
| B.当0<V(HCl)<10mL时,甲溶液中发生反应的离子方程式为: OH-+H+=H2O |
| C.乙溶液中含有的溶质是NaOH、NaHCO3 |
| D.乙溶液中滴加盐酸后产生CO2体积的最大值为112mL(标准状况) |
使用容量瓶配置溶液时,由于操作不当会引起误差,下列情况会使所配溶液浓度偏低的是 ( )
①用天平称量时所用砝码生锈
②用量筒量取所需浓溶液时,仰视刻度
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,俯视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
| A.②⑤ | B.②③⑥ | C.①⑤⑥ | D.③⑥ |
设NA为阿伏加德罗常数的值,下列叙述正确的是 ( )
| A.标准状况下, 22.4 L H2O含有分子数为NA |
| B.分子总数为NA的N2、CO混合气体体积约为22.4 L,质量为28 g |
| C.常温常压下,1.6 g CH4含原子数为0.5NA |
| D.足量的CO2与39 g Na2O2发生反应,转移的电子数为NA |