题目内容
10.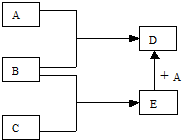 已知A、B、C、D、E均为常见物质,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略).
已知A、B、C、D、E均为常见物质,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略).请回答:
(1)若A为金属单质Fe,B、C为非金属单质,且常温下B、C均为无色气体,D为黑色晶体,则B的分子式为O2,A和E在一定条件下反应生成D的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
(2)若A为非金属单质,B为金属单质,C为常见酸,且C的组成中含有与A相同的元素.则C的分子式为HCl,A和E在一定条件下反应生成D的离子方程式为2Fe2++Cl2=2Fe3++2Cl-.
(3)若A、C分别为常见强酸和常见强碱,B为金属氧化物,则B的分子式为Al2O3,A和E在一定条件下反应生成D的离子方程式为AlO2-+4H+=Al3++2H2O.
分析 (1)A为Fe,B、C为非金属单质,且常温下B、C均为无色气体,D为黑色晶体,则D为Fe3O4,B为O2,C为H2,E为H2O;
(2)若A为非金属单质,B为金属单质,由转化关系可知,B为变价金属,A具有强氧化性,C为常见酸,且C的组成中含有与A相同的元素,则A为Cl2,B为Fe,C为HCl,E为FeCl2,D为FeCl3;
(3)若A、C分别为常见强酸和常见强碱,B为金属氧化物,B既能与强酸反应又能与强碱反应,则B为Al2O3,B与强酸A反应生成D中含有Al3+,B与强碱反应生成的E中含有AlO2-,E与过量的强酸反应可以生成E,据此答题.
解答 解:(1)A为Fe,B、C为非金属单质,且常温下B、C均为无色气体,D为黑色晶体,则D为Fe3O4,B为O2,C为H2,E为H2O,A与E在一定条件下反应生成D的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:O2;3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(2)若A为非金属单质,B为金属单质,由转化关系可知,B为变价金属,A具有强氧化性,C为常见酸,且C的组成中含有与A相同的元素,则A为Cl2,B为Fe,C为HCl,E为FeCl2,D为FeCl3,A和E在一定条件下反应生成D的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:HCl;2Fe2++Cl2=2Fe3++2Cl-;
(3)(3)若A、C分别为常见强酸和常见强碱,B为金属氧化物,B既能与强酸反应又能与强碱反应,则B为Al2O3,B与强酸A反应生成D中含有Al3+,B与强碱反应生成的E中含有AlO2-,E与过量的强酸反应可以生成E,反应的离子方程式为AlO2-+4H+=Al3++2H2O,
故答案为:Al2O3;AlO2-+4H+=Al3++2H2O.
点评 本题考查无机物的推断,难度中等,需要学生熟练掌握元素化合物知识,以Fe、Na、Al为主要金属及其化合物之间的转化.

| A. | ①③⑤⑦ | B. | ②③⑦ | C. | ①⑥ | D. | ②④⑦ |
| A. | Na | B. | S | C. | O | D. | Cl |
| A. | 铝合金、钢 | B. | 加碘食盐、纯碱 | C. | 冰水、冰镇汽水 | D. | 氧气、空气 |
| 选项 | 物质 | 杂质 | 试剂、方法 |
| A | O2 | 水蒸气 | 通过浓H2SO4洗气 |
| B | MnO2 | 炭粉 | 在空气中灼烧 |
| C | KCl溶液 | BaCl2 | 加入适量的Na2SO4溶液,过滤 |
| D | FeSO4溶液 | CuSO4 | 加入足量铁屑,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA | |
| B. | 26g乙炔所含共用电子对数目为3NA | |
| C. | 标准状况下,11.2 L CCl4所含分子数为0.5NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
| A. | N2的电子式:N??N | |
| B. | S2-的结构示意图: | |
| C. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{131}$I | |
| D. | 苯的最简式:C6H6 |
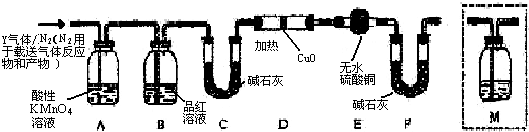
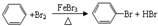 ,预测该芳香烃能(填“能”或“不能”)发生该类反应.
,预测该芳香烃能(填“能”或“不能”)发生该类反应. b.
b. c.
c.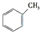
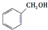 c.
c.
