题目内容
【题目】下列实验装置设计正确、且能达到目的是( ) 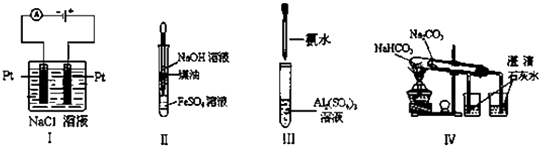
A.实验Ⅰ:制备金属钠
B.实验Ⅱ:制取氢氧化亚铁并观察其颜色
C.实验Ⅲ:制取少量的氢氧化铝
D.实验Ⅳ:比较两种物质的热稳定性
【答案】BC
【解析】解:A.Na是活泼金属,工业上采用电解熔融氯化钠的方法冶炼,如果电解食盐水,则阴极上氢离子放电而不是钠离子放电,所以得不到钠,故A错误; B.氢氧化亚铁不稳定,易被空气中氧气氧化生成红棕色的氢氧化铁,为防止氢氧化亚铁被氧化,则制备氢氧化亚铁时要隔绝空气,煤油的密度小于水,所以能隔绝空气,故B正确;
C.氢氧化铝不溶于弱碱,实验室用氨水和可溶性铝盐制取氢氧化铝,故C正确;
D.比较两种物质的热稳定性时碳酸钠要放置在大试管中,如果温度高的碳酸钠不分解而温度低的碳酸氢钠分解,说明碳酸钠的稳定性大于碳酸氢钠,故D错误;
故选BC.

【题目】汽车尾气是造成雾霾天气的原因之一.
(1)汽车尾气中含有CO、NO2等有毒气体对汽车加装尾气净化装置可使有毒气体相互反应转化为无毒气体. 写出该反应的热化学方程式 .
N2(g)+2O2(g)═2NO2(g)△H=+68.0kJmol﹣1;
2C(s)+O2(g)═2CO(g)△H=﹣221.0kJmol﹣1;
C(s)+O2(g)═CO2(g)△H=﹣393.5kJmol﹣1
(2)汽车尾气中含有CO和H2O(g)在一定条件下可以发生反应
CO(g)+H2O(g)CO2(g)+H2(g)△H<0.850℃在体积为10L反应器中通入一定量的CO和H2O(g)发生上述反应CO和H2O(g)的浓度变化如图所示则0﹣4min是平均反应速率v(H2O)=此时K= .
起始物质的量 | 甲 | 乙 | 丙 |
n(H2O)/mol | 0.10 | 0.20 | 0.20 |
n(CO)/mol | 0.10 | 0.10 | 0.20 |
850℃在甲、乙、丙三个1L的恒容密闭容器中,起始时按照表进行投料,达到平衡状态.平衡时甲容器中CO的转化率是 . 比较下列容器中CO的转化率甲乙(填“大于”、“<”或“等于”).


