题目内容
【题目】SO2的含量是衡量大气污染的一个重要指标,工业上常采用催化还原法或吸收法处理SO2。利用催化还原SO2不仅可消除SO2污染,而且可得到有经济价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和H2O。
己知CH4和S的燃烧热(△H)分别为-890.3 kJ /mol和-297.2 kJ /mol,则CH4和SO2反应的热化学方程式为 _________________________________________________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
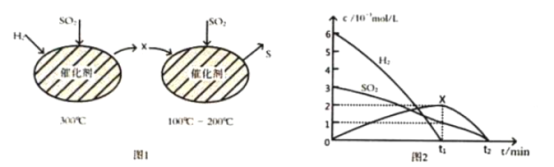
①分析可知X为________(写化学式), 0~t1时间段的温度为_____, 0~t1时间段用SO2表示的化学反应速率为 ___________________________。
②总反应的化学方程式为__________________________________________________________。
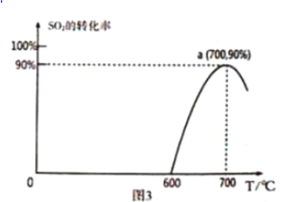
(3)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
S2(g)+2CO2(g),恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
①该反应的△H _________________________ 0 (填“>”或“<”)
②计算700℃该反应的平衡常数为____________________ 。
【答案】CH4(g)+2SO2(g)=CO2(g)+2S(s)+2H2O(l) △H=-295.9kJ/mol H2S 300℃ 2×10-3/t1mol/(Lmin) 2H2+SO2![]() S+2H2O < 36.45mol/L
S+2H2O < 36.45mol/L
【解析】
(1)CH4的燃烧的热化学反应方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ·mol-1 ①,S燃烧的热化学反应方程式为S(s)+O2(g)=SO2(g) △H=-297.2kJ·mol-1 ②,CH4和SO2反应的方程式为CH4+2SO2=2S+CO2+2H2O,
因此有①-2×②得出CH4(g)+SO2(g)=2S(s)+CO2(g)+2H2O(l) △H=(-890.3+2×297.2)kJ·mol-1=-295.9kJ·mol-1;
(2)①H2还原SO2发生反应:2H2+SO2=S+2H2O,图1右侧,SO2→S,S元素的化合价降低,根据氧化还原反应特点,化合价有升高,必然有降低,因此推出X为H2S;0~t1时间,X的浓度达到最大,应是图1左侧反应,4H2+SO2=H2S+2H2O,温度应为300℃;根据化学反应速率的表达式,v(SO2)=(3-1)/t1mol/(L·min);
②根据上述分析,总反应的化学方程式为2H2+SO2![]() S+2H2O;
S+2H2O;
(3)①根据图像,700℃SO2的转化率达到最大,反应达到平衡,右侧随着温度的升高,SO2的转化率降低,根据勒夏特列原理,正反应为放热反应,即△H<0;
②2C(s)+2SO2(g)![]() S2(g)+2CO2(g)
S2(g)+2CO2(g)
起始: 1 0 0
变化: 0.9 0.45 0.9
平衡: 0.1 0.45 0.9 化学平衡常数的表达式为K=[c(S2)×c2(CO2)]/c2(SO2),代入数值,得出K=36.45。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案


