题目内容
 (1)如图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间.试回答:
(1)如图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间.试回答:①该反应的反应物是
A
A
.②该反应的化学方程式为
2A?B+3C
2A?B+3C
.③达到平衡状态的所需时间是2min,A物质的平均反应速率为
0.4mol/(Lmin)
0.4mol/(Lmin)
.(2)已知反应 A(g)+3B(g)?2C(g) 在一定温度下达到平衡,反应的平衡常数表达式为
| C2(C) |
| C(A).C3(B) |
| C2(C) |
| C(A).C3(B) |
分析:(1)①随着反应的进行,反应物的浓度降低,生成物的浓度增大,据此结合图象判断.
②根据浓度变化量之比等于化学计量数之比确定化学计量数,t是达到平衡状态,为可逆反应,据此书写方程式.
③由图可知△c(A)=1.0mol/L-0.2mol/L=0.8mol/L,根据v=
计算A物质的平均反应速率.
(2)K=
.
②根据浓度变化量之比等于化学计量数之比确定化学计量数,t是达到平衡状态,为可逆反应,据此书写方程式.
③由图可知△c(A)=1.0mol/L-0.2mol/L=0.8mol/L,根据v=
| △C |
| △t |
(2)K=
| C2(C) |
| C(A).C3(B) |
解答:解:(1)①由图可知,随着反应的进行,A的浓度降低,B、C的浓度增大,故A为反应物,B、C为生成物;
故答案为:A.
②由图可知,△c(A)=)=1.0mol/L-0.2mol/L=0.8mol/L,△c(B)=0.4mol/L,△c(C)=1.2mol/L,A、B、C化学计量数之比等于浓度变化量之比为0.8mol/L:0.4mol/L:1.2mol/L=2:1:3,反应为可逆反应,故反应方程式为2A?B+3C.
故答案为:2A?B+3C.
③由图可知△c(A)=1.0mol/L-0.2mol/L=0.8mol/L,所v(A)=
=0.4mol/L.min;
故答案为0.4 mol/(L min);
(2)K=
;
故答案为:
.
故答案为:A.
②由图可知,△c(A)=)=1.0mol/L-0.2mol/L=0.8mol/L,△c(B)=0.4mol/L,△c(C)=1.2mol/L,A、B、C化学计量数之比等于浓度变化量之比为0.8mol/L:0.4mol/L:1.2mol/L=2:1:3,反应为可逆反应,故反应方程式为2A?B+3C.
故答案为:2A?B+3C.
③由图可知△c(A)=1.0mol/L-0.2mol/L=0.8mol/L,所v(A)=
| 0.8mol/L |
| 2min |
故答案为0.4 mol/(L min);
(2)K=
| C2(C) |
| C(A).C3(B) |
故答案为:
| C2(C) |
| C(A).C3(B) |
点评:本题考查了方程式的确定、平均反应速率的计算、化学平衡常数的表达式等知识点,难度不大,注意化学平衡常数表达式中不能有固体或纯液体,为易错点.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
 如图表示800℃时A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间,试回答:
如图表示800℃时A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间,试回答: 如图表示800℃时A、B、C三种气体物质的浓度随时间变化的情况,t是到达平衡状态的时间.试回答:
如图表示800℃时A、B、C三种气体物质的浓度随时间变化的情况,t是到达平衡状态的时间.试回答: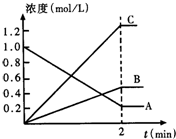 如图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t表示时间.试回答:
如图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t表示时间.试回答: