题目内容
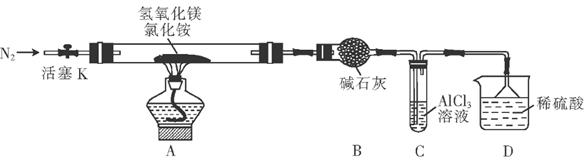
(10分)为提高氯化铵的经济价值,我国化学家设计了利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁(MgOHCl)的工艺。某同学根据该原理设计的实验装置如图:
请回答下列问题:
(1) 装置A中发生反应生成碱式氯化镁的化学方程式为_____________;装置B中碱石灰的作用是_______。
(2) 反应过程中持续通入N2的作用有两点:一是使反应产生的氨气完全导出并被稀硫酸充分吸收,二是_____________________。
(3) 装置C的试管中产生的现象是______________,反应的离子方程式为

请回答下列问题:
(1) 装置A中发生反应生成碱式氯化镁的化学方程式为_____________;装置B中碱石灰的作用是_______。
(2) 反应过程中持续通入N2的作用有两点:一是使反应产生的氨气完全导出并被稀硫酸充分吸收,二是_____________________。
(3) 装置C的试管中产生的现象是______________,反应的离子方程式为
(1)Mg(OH)2+NH4Cl MgOHCl+NH3↑+H2O 干燥氨气
MgOHCl+NH3↑+H2O 干燥氨气
(2)防止装置D中的AlCl3溶液倒吸入装置C
(3)产生白色沉淀 Al3++3NH3·H2O=Al(OH)3(沉淀)+3NH4+
 MgOHCl+NH3↑+H2O 干燥氨气
MgOHCl+NH3↑+H2O 干燥氨气(2)防止装置D中的AlCl3溶液倒吸入装置C
(3)产生白色沉淀 Al3++3NH3·H2O=Al(OH)3(沉淀)+3NH4+
试题分析:(1)装置A中的反应方程式为:Mg(OH)2+NH4Cl
 MgOHCl+NH3↑+H2O。碱石灰用来干燥生成的氨气。
MgOHCl+NH3↑+H2O。碱石灰用来干燥生成的氨气。(2)氨气是极易溶于水的气体,在C装置处会发生倒吸,所以氮气的持续通入可以防止C装置发生倒吸。
(3)向AlCl3溶液中通入氨气只能看到产生白色沉淀,因为氨水是弱碱不能将Al(OH)3溶解。
点评:本题综合性较强,但是知识点很基础简单。

练习册系列答案
相关题目
 2KNO2+O2↑,
2KNO2+O2↑,