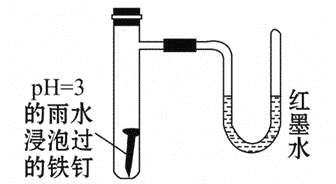
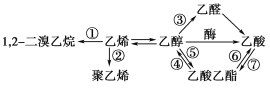
题目内容
【题目】19.2g铜投入100mL 14mol/L浓HNO3 溶液中,充分反应后无固体剩余,收集到标准状况下气体8.96L。计算:
(1)所得气体的质量_____
(2)向反应后的溶液中加入多少毫升10mol/L NaOH溶液才能使Cu2+完全沉淀?____
【答案】16.8g 60
【解析】
本题考核Cu和浓硝酸的反应,反应中涉及两个反应:Cu和浓硝酸反应生成硝酸铜和二氧化氮和水,随着反应的进行,浓硝酸变成稀硝酸,继续与Cu反应,生成硝酸铜、一氧化氮和水。
(1)在上述反应过程中,Cu原子失去电子,变为Cu2+,NO3-中的N原子得到电子,被还原为NO2、NO,根据反应过程中电子得失守恒以及NO、NO2的物质的量的关系进行求解。
(2)向反应后的溶液中加入NaOH溶液使Cu2+转化为Cu(OH)2沉淀,可根据Cu(OH)2中Cu2+与OH-的量的关系进行求解。
(1)收集到标准状况下气体的物质的量为:![]()
设收集到的气体中NO2的物质的量为x,NO的物质的量为y,据题意有:
![]()
Cu原子失去电子,变为Cu2+,NO3-中的N原子得到电子,被还原为NO2、NO,根据电子得失守恒有:![]() ,即
,即![]()
联立方程组,得:
![]() 解得:
解得:![]()
故所得气体的质量=![]()
答案为:16.8g。
(2)向反应后的溶液中加入NaOH溶液使Cu2+转化为Cu(OH)2沉淀,在Cu(OH)2中Cu2+的物质的量与OH-的物质的量的关系为:![]() ,则NaOH的体积为:
,则NaOH的体积为:![]() 。故向反应后的溶液中加入60毫升10mol/L NaOH 溶液才能使Cu2+完全沉淀。答案为:60。
。故向反应后的溶液中加入60毫升10mol/L NaOH 溶液才能使Cu2+完全沉淀。答案为:60。

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案【题目】电镀行业产生的酸性含铬废水对环境有污染,其中所含的Cr(VI)是主要污染物,可采用多种方法处理将其除去,查阅资料可知: 常温下,部分阳离子以氢氧化物形式沉淀时溶液的 pH 如下表:
阳离子 | Fe3+ | Fe2+ | Cr3+ |
开始沉淀的 pH | 1.9 | 7.0 | 4.3 |
沉淀完全的 pH | 3.2 | 9.0 | 5.6 |
I.腐蚀电池法
(1)向酸性含铬废水中投放废铁屑和焦炭,利用原电池原理还原 Cr(VI)。下列关于铁屑的说法中正确的是______________(填字母序号)。
a.作原电池的正极 b.在反应中作还原剂 c.铁屑生成 Fe3+可以进一步还原![]()
II.电解还原法
向酸性含铬废水中加入适量NaCl固体,以Fe为电极电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准。装置如下图所示。

(2)B极连接电源的___________极;
(3)电解开始时,B 极上主要发生的电极反应为2H++2e-= H2↑,此外还有少量![]() 在B极上直接放电,该反应的电极反应式为 _______________。
在B极上直接放电,该反应的电极反应式为 _______________。
(4)①酸性环境可以促使![]() 到
到![]() 的转化,写出对应的离子方程式:__________________;
的转化,写出对应的离子方程式:__________________;
②写出酸性环境中 Fe2+还原![]() 的离子方程式_______________________。
的离子方程式_______________________。