题目内容
8.2011年3月11日日本发生了9.0级强地震.福岛第一核电站1号机组12日下午发生的氢气爆炸.随后在爆炸核电站周围检测到的放射性物质有碘131和铯137.碘131一旦被人体吸入,可能会引发甲状腺疾病.日本政府计划向核电站附近居民发放防止碘131辐射的药物碘片.(1)Cs(铯)的最外层电子排布式为6s1,与铯同主族的前四周期(包括第四周期)的三种元素A、B、C的电离能如下表:
| 元素代号 | A | B | C |
| 第一电离能(kJ•mol-1) | 520 | 496 | 419 |
(2)F与I同主族,BeF2与H2O都是由三个原子构成的共价化合物分子,二者分子中的中心原子Be和O的杂化方式分别是sp、sp3.
(3)与碘同主族的氯具有较高的活泼性,能够形成大量的含氯化合物,如金属氯化物,非金属氯化物等.BCl3是一种非金属氯化物,该物质分子中B-Cl键的键角为120°.
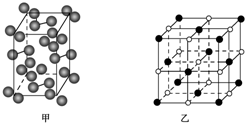
(4)碘131是碘单质,其晶胞结构如下图所示,该晶胞中含有4个I2分子;KI的晶胞结构如下图乙所示,每个K+紧邻6个I-.
分析 (1)由铯的最外层电子排布式为6s1,可知A、B、C为第ⅠA族,而ⅠA族前四周期的元素分别为H、Li、Na、K,又由提供的A、B的第一电离能的差值与B、C的第一电离能的差值相差不大可知,A、B、C不可能有H元素,而同主族元素随着电子层数的增加,第一电离能逐渐减小,故A、B、C分别为Li、Na、K.
(2)BeF2分子内中心原子为Be,其价电子数为2,F提供2个电子,根据Be原子的价层电子对数判断Be原子的杂化类型;根据H2O分子的中心原子为O的价电子数判断原子杂化类型;
(3)硼原子价电子数为3,Cl提供3个电子,据此判断硼原子的价层电子对数,因价层电子对中没有孤对电子,故BCl3为平面正三角形结构,分子中B-Cl键的键角为120°.
(4)由碘晶胞可知,I2在晶胞的8个顶点和6个面上,根据均摊法计算I2分子;根据NaCl晶胞结构判断K+紧邻的I-.
解答 解:(1)由铯的最外层电子排布式为6s1,可知A、B、C为第ⅠA族,而ⅠA族前四周期的元素分别为H、Li、Na、K,又由提供的A、B的第一电离能的差值与B、C的第一电离能的差值相差不大可知,A、B、C不可能有H元素,而同主族元素随着电子层数的增加,第一电离能逐渐减小,故A、B、C分别为Li、Na、K;都是金属单质,微粒均以金属键结合,
故答案为:Li、Na、K;金属键;
(2)BeF2分子内中心原子为Be,其价电子数为2,F提供2个电子,所以Be原子的价层电子对数为$\frac{2+2}{2}$=2,Be原子的杂化类型为sp杂化;H2O分子的中心原子为O,其价电子数为6,H提供2个电子,所以O原子的价层电子对数为$\frac{6+2}{2}$=4,O原子杂化类型为sp3,
故答案为:sp;sp3;
(3)硼原子价电子数为3,Cl提供3个电子,硼原子的价层电子对数为$\frac{3+3}{2}$=3,因价层电子对中没有孤对电子,故BCl3为平面正三角形结构,分子中B-Cl键的键角为120°,
故答案为:120°;
(4)由碘晶胞可知,I2在晶胞的8个顶点和6个面上,故一个晶胞中含有I2分子数为$8×\frac{1}{8}+6×\frac{1}{2}$=4;KI晶胞与NaCl晶胞结构相似,每个K+紧邻6个I-,
故答案为:4;6.
点评 本题综合考查物质结构与性质,涉及核外电子排布规律、电离能、杂化理论、分子结构、晶胞结构等,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 氢氟酸保存于棕色玻璃瓶中 | B. | 新制的氯水保存于棕色玻璃瓶中 | ||
| C. | 实验室少量的钠保存于煤油中 | D. | 浓硝酸运输时保存在铝制容器中 |
| A. |  $→_{95℃}^{62%H_{2}SO_{4}}$ CH3CH=CHCH3+H2O $→_{95℃}^{62%H_{2}SO_{4}}$ CH3CH=CHCH3+H2O | |
| B. | CH3CH2Br+NaOH→CH3CH2OH+NaBr | |
| C. | CH3COOH+CH3OH $?_{加热}^{催化剂}$?CH3COOCH3+H2O | |
| D. | RCOOCH3+H2O $\stackrel{H_{2}SO_{4}}{?}$ RCOOH+CH3OH |
| 实验目的 | 操作 | |
| A | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| B | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫红色是否褪去 |
| C | 确定溴乙烷中含有溴元素 | 与NaOH溶液共热,再往混合液中滴加AgNO3溶液,观察是否有浅黄色沉淀生成 |
| D | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
| A. | A | B. | B | C. | C | D. | D |
(2)请选用适当的试剂和分离方法除去下列物质中所含的杂质(括号内为杂质),将所选的试剂及装置的编号填入表中.
试剂:a.水 b.NaOH溶液 c.溴水 d.饱和Na2CO3溶液e.新制CaO f.饱和NaCl溶液
分离方法:A.分液 B.过滤 C.洗气 D.蒸馏 F.盐析
| 混合物 | 需加入的试剂 | 分离方法 |
| ①苯(苯酚) | ||
| ②乙烷(乙烯) | ||
| ③乙醇(水) | ||
| ④乙酸乙酯(乙酸) |
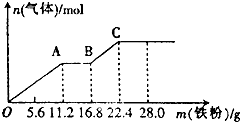 某稀硫酸和稀硝酸的混合溶液200mL,将其分成两等份.向第一份中逐渐加入铜粉,最多能溶解19.2g(假设硝酸仅被还原为N0气体,下同).向第二份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,将其分成两等份.向第一份中逐渐加入铜粉,最多能溶解19.2g(假设硝酸仅被还原为N0气体,下同).向第二份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )| A. | 原混合溶液中NO3-的物质的量为0.4 mol | |
| B. | OA段、BC段产生的气体分别是N0、H2 | |
| C. | 第二份溶液中最终溶质为FeS04 | |
| D. | 原混合溶液中H2S04的浓度为5 mol•L-1 |
| A. | 将浓硫酸缓慢倒入水中并不断搅拌,得到稀硫酸,置镁条于其中探究Mg的活泼性 | |
| B. | 将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀 | |
| C. | 将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成 | |
| D. | 将Mg(OH)2沉淀转入表面皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体 |
| A. | 产生的气体可以使带火星的木条复燃 | |
| B. | 1mol过氧化钠完全参加反应,将转移电子2mol | |
| C. | 反应后的溶液中滴加酚酞后溶液将变红,震荡后红色不消失 | |
| D. | 该反应是放热反应 |
| A. | H+、NO3-、Fe2+、Na+ | B. | Ag+、NO3-、Cl-、K+ | ||
| C. | K+、Ba2+、OH-、SO42- | D. | Cu2+、NH4+、Br-、OH- |