题目内容
5.现有标准状况下CH4 3.36L,则该CH4气体的质量2.4g,所含氢原子的数目为0.6NA,与1.5mol H2O分子中所含质子数相等.分析 结合n=$\frac{V}{Vm}$、m=nM及分子构成计算.
解答 解:n(CH4)=$\frac{3.36L}{22.4L/mol}$=0.15mol,m(CH4)=0.15mol×16g/mol=2.4g,含H原子为0.15mol×4×NA=0.6NA;
含质子为0.15mol×10=1.5mol,1个水分子含10个质子,则0.15molH2O分子含1.5mol质子,
故答案为:2.4g;0.6NA;1.5.
点评 本题考查物质的量的计算,为高频考点,把握物质的量、质量、体积的关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
15.X、Y、Z、M为4种短周期元素,X、Y位于同周期且原子半径X>Y,Y2-与M+的电子层结构相同,Z与X的原子核外最外层电子数相同,Z的单质可制成半导体材料.下列说法不正确的是( )
| A. | 晶体 H2Y的分子之间为密集堆积 | |
| B. | XY2、ZY2、M2Y的晶体分别属于3种不同类型的晶体 | |
| C. | 单质M的晶体是体心立方堆积,M的配位数是8 | |
| D. | 由元素X与Z形成的化合物中只含共价键 |
10.在容积为2L密闭容器中,保持体系内温度800℃不变,将一定量的NO和O2混合发生反应:2NO+O2═2NO2,其中NO的物质的量[n(NO)]随时间的变化如表:
请回答问题:用O2表示达到平衡(假设30s刚刚达到平衡)时反应速率0.0011mol/(L.s),0~10s与10~20s的反应速率之比为5:1.
| 时间/s | 0 | 10 | 20 | 30 | 40 | 50 |
| n(NO)/mol | 0.2 | 0.1 | 0.08 | 0.07 | 0.07 | 0.07 |
14.为确定某溶液的离子组成,分别进行如下实验:
①测定溶液的pH,溶液显强碱性.
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体.
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀.
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
根据实验以下推测正确的是( )
①测定溶液的pH,溶液显强碱性.
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体.
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀.
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
根据实验以下推测正确的是( )
| A. | 不一定有SO42-离子 | B. | 一定有CO32-离子 | ||
| C. | Cl-离子一定存在 | D. | 一定没有SO42-离子 |
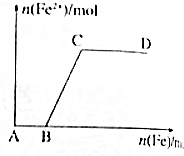 在一定量的稀HNO3中缓慢加入铁粉,得到的Fe2+的物质的量(纵坐标)与所加铁粉的物质的量(横坐标)的关系如图所示,请将正确答案的序号填在相应的横线上.
在一定量的稀HNO3中缓慢加入铁粉,得到的Fe2+的物质的量(纵坐标)与所加铁粉的物质的量(横坐标)的关系如图所示,请将正确答案的序号填在相应的横线上.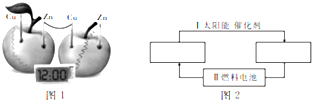 电化学知识可广泛应用于生产生活实际之中.
电化学知识可广泛应用于生产生活实际之中.