题目内容
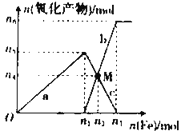
【题目】在1 L 2 mol·L-1稀硝酸溶液中逐渐加入铁粉,反应中氧化产物的物质的量与加入铁粉的物质的量的关系如图所示:
回答下列问题:
(1)与曲线a对应的离子方程式为_____。
(2)曲线b代表的微粒为_____________,n2的值为__________。
(3)若M点时再加入V L 2 mol·L-1的稀硝酸,恰好反应完全,则V为_____________。
(4)研究表明硝酸的浓度越小,反应后氮的化合价越低。在极稀的硝酸溶液中加入少量铁粉,生成NH4+的离子方程式为_________。
【答案】Fe+NO3-+4H+=Fe3++NO↑+2H2O Fe2+ 0.6 0.2 8Fe+3NO3-+30H+=8Fe3++3NH4++9H2O
【解析】
向稀硝酸中加入铁粉时,发生两个过程,开始先生成Fe(NO3)3,反应方程式为:Fe+4 HNO3(稀)= Fe(NO3)3+NO↑+2H2O,Fe(NO3)3与过量的铁继续反应生成 Fe(NO3)2,反应方程式为:2 Fe(NO3)3+Fe=3 Fe(NO3)2,由此分析解答。
(1)曲线a代表Fe+4HNO3(稀)= Fe(NO3)3+NO↑+2H2O,离子方程式为:Fe+NO3-+4H+=Fe3++NO↑+2H2O;
(2)根据反应Fe+4 HNO3(稀)= Fe(NO3)3+NO↑+2H2O,1 L 2 mol·L-1稀硝酸溶液参与反应,则此时消耗Fe的物质的量为0.5mol,曲线b代表的微粒为亚铁离子,加铁粉从n1到n2发生反应2Fe(NO3)3+Fe=3Fe(NO3)2,且M点n(Fe3+)=n(Fe2+),
即 2Fe3+~~~Fe~~~3Fe2+,
开始0.5mol 0 0
转化 2x x 3x
M点 0.5-2x 3x
所以0.5-2x =3x,x=0.1mol,故M点消耗铁的物质的量为0.5mol+0.1mol=0.6mol;
(3)M点时再加入VL2mol/L的稀硝酸,恰好反应完全,说明硝酸与0.6mol的铁恰好完全反应生成铁离子,而稀硝酸参加氧化还原反应,氧化性的硝酸占![]() ,根据得失电子守恒得3×0.6mol=
,根据得失电子守恒得3×0.6mol=![]() ×2×(1+V)×3,解之得V=0.2L;
×2×(1+V)×3,解之得V=0.2L;
(4)极稀的硝酸液中加入少量铁粉,生成NH4+的离子方程式为:8Fe+3NO3-+30H+=8Fe3++3NH4++9H2O。

【题目】无机化合物可根据其组成和性质进行分类。
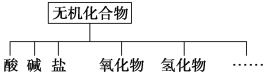
(1)如图所示的物质分类方法的名称是______________。
(2)
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①HCl ②______ | ③________ ④Ba(OH)2 | ⑤Na2CO3 ⑥_______ | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在上表中②③⑥后面。
(3)写出⑦转化为⑤的化学方程式_______。