题目内容
【题目】下列有关说法错误的是
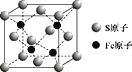
A. NaCl晶胞中Na+的配位数为6且构成正八面体
B. 由石墨比金刚石稳定可知:C(金刚石,s) ===C(石墨,s) ΔH>0
C. 已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol。假设熔化热完全用于打破冰的氢键,最多能破坏冰中15%的氢键,则每摩尔冰中平均有2 mol氢键
D. 石墨中的碳原子采用sp2杂化构成平面层状结构,12g石墨中碳碳键数为1.5NA
【答案】B
【解析】
A、NaCl晶体中,距Na+最近的Cl-有6个,这6个离子构成一个正八面体,故A正确;B、石墨比金刚石稳定,说明等质量时,石墨的总能量小于金刚石的总能量,因此金刚石转化为石墨是放热反应,△H<0,故B错误;C、冰的熔化热相当于破坏![]() mol也就是0.3mol氢键所需的能量,若熔化热最多能破坏15%的氢键,则每摩尔冰中平均有氢键
mol也就是0.3mol氢键所需的能量,若熔化热最多能破坏15%的氢键,则每摩尔冰中平均有氢键![]() =2mol,故C正确;D、石墨中每个碳原子形成3个共价键,则碳原子的价层电子对数为3,所以属于sp2杂化,每个共价键由两个碳原子构成,则平均1mol碳原子具有1.5mol碳碳单键,所以12g石墨中含有碳碳键数为1.5NA,故D错误。故选B。
=2mol,故C正确;D、石墨中每个碳原子形成3个共价键,则碳原子的价层电子对数为3,所以属于sp2杂化,每个共价键由两个碳原子构成,则平均1mol碳原子具有1.5mol碳碳单键,所以12g石墨中含有碳碳键数为1.5NA,故D错误。故选B。

练习册系列答案
相关题目