题目内容
【题目】(1)写出下列反应的离子方程式。
①酸性KMnO4溶液和草酸(H2C2O4)溶液反应_____。
②硫代硫酸钠与稀硫酸反应_____。
③用硫氰化钾溶液检验Fe3+_____。
(2)利用电解技术,以氯化氢为原料回收氯气的过程如图所示,回答下列问题:H+由_____极区向_____极区迁移(填阴、阳);阳极电极反应式:____;阴极电极反应式:______。

(3)燃料种类很多,如氢氧燃料电池(如KOH为电解液)。写出该电池电极反应式正极:______;负极:_____。
(4)氯碱工业原理的化学方程式:______。如图为用阳离子交换膜法进行该工业生产的装置示意图,标出a~f处所对应的原料或产品:_____。

生成0.4kg烧碱时,转移电子的物质的量是____mol。(相对原子质量Na-23、H-1、O-16)
【答案】2MnO4-+ 5H2C2O4+6H+=2Mn2++10CO2↑+8H2O S2O32-+2H+=SO2+S↓+H2O Fe3++3SCN-=Fe(SCN)3 阳 阴 2HCl -2e-=Cl2↑+2H+ Fe3++e- =Fe2+ O2+4e-+2H2O=4OH- 2H2-4e-+4OH-=4H2O 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ 饱和食盐水、稀氢氧化钠溶液、氯气、较稀的食盐水、氢气、较浓的氢氧化钠溶液 10
2NaOH+H2↑+Cl2↑ 饱和食盐水、稀氢氧化钠溶液、氯气、较稀的食盐水、氢气、较浓的氢氧化钠溶液 10
【解析】
根据化合价的变化规律,分析氧化还原反应中的氧化产物和还原产物,根据书写离子方程式的一般要求写出离子方程式。根据原电池原理和电解原理分析燃料电池的电解池中的相关变化。
(1)①酸性KMnO4溶液和草酸(H2C2O4)溶液反应,KMnO4是氧化剂,其被还原为Mn2+,草酸(H2C2O4)是还原剂,其被氧化为CO2,根据化合价的变化规律及质量守恒定律可知,该反应的离子方程式为2MnO4-+ 5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 。
②硫代硫酸钠与稀硫酸反应生成硫酸钠、二氧化硫、硫和水,该反应的离子方程式为S2O32-+2H+=SO2+S↓+H2O。
③用硫氰化钾溶液检验Fe3+,该反应中生成能使溶液呈血红色的配合物,其离子方程式通常表示为Fe3++3SCN-=Fe(SCN)3。
(2)由图中信息可知,氯化氢在阳极氧化为氯气,Fe3+在阴极还原为Fe2+,然后O2被Fe2+还原为H2O,因此,H+由阳极区向阴极区迁移;阳极的电极反应式为2HCl -2e-=Cl2↑+2H+;阴极电极反应式为Fe3++e- =Fe2+,阴极区的总反应为O2+4 e-+4H+=2H2O。
(3)氢氧燃料电池(KOH为电解液)中,氢气在负极发生氧化反应,氧气在正极发生还原反应,该电池正极的电极反应式为O2+4e-+2H2O=4OH-,负极的电极反应式为2H2-4e-+4OH-=4H2O。
(4)氯碱工业中,通过电解饱和食盐水制备烧碱、氯气和氢气,该反应的化学方程式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。由图中信息可知,左室为阳极室,右室为阴极室,则图中a~f所对应的物质分别是饱和食盐水、稀氢氧化钠溶液、氯气、较稀的食盐水、氢气、较浓的氢氧化钠溶液。
2NaOH+H2↑+Cl2↑。由图中信息可知,左室为阳极室,右室为阴极室,则图中a~f所对应的物质分别是饱和食盐水、稀氢氧化钠溶液、氯气、较稀的食盐水、氢气、较浓的氢氧化钠溶液。
当生成0.4kg烧碱时,烧碱的物质的量为![]() =10mol,由阴极的电极反应式2H2O+2e-=H2↑+2OH-可知,n(e-)= n(OH-)=10mol,故转移电子的物质的量是10mol。
=10mol,由阴极的电极反应式2H2O+2e-=H2↑+2OH-可知,n(e-)= n(OH-)=10mol,故转移电子的物质的量是10mol。

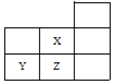
【题目】如图是元素周期表的一部分:
数据编号 | 滴入NaOH溶液的体积 | 溶液的pH | |
HX | HZ | ||
1 | 0 | 3 | 1 |
2 |
| a | b |
![]() 时,用浓度为
时,用浓度为![]() 的氢氧化钠溶液分别滴定
的氢氧化钠溶液分别滴定![]() 浓度均为
浓度均为![]() 的两种酸HX、
的两种酸HX、![]() 忽略体积变化
忽略体积变化![]() ,实验数据如表2,下列判断正确的是
,实验数据如表2,下列判断正确的是![]()
A.通过分析可得表格中![]() ,
,![]()
B.将上述的HZ溶液稀释100倍后pH比HX溶液的pH大
C.由于Z元素的非金属性比Y强,所以Z氢化物的酸性较强
D.![]()
![]()
![]() 的水溶液中:
的水溶液中:![]()
![]()