题目内容
浓硝酸受热分解:4HNO3═4NO2↑+O2↑+2H2O,该反应中被氧化的氧元素与被还原的氮元素的原子个数比是( )
分析:反应4HNO3═4NO2↑+O2↑+2H2O中,N元素化合价降低,被还原,O元素化合价生成,被氧化,结合化学方程式进行判断.
解答:解:反应4HNO3═4NO2↑+O2↑+2H2O中,N元素化合价降低,被还原,O元素化合价生成,被氧化,由方程式可知,当有1mol O2生成时,有4mol NO2生成,则该反应中被氧化的氧元素与被还原的氮元素的原子个数比是2:4=1:2,
故选A.
故选A.
点评:本题考查氧化还原反应,侧重于学生的分析能力的考查,为高考高频考点,注意从元素化合价的角度分析该类题目,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

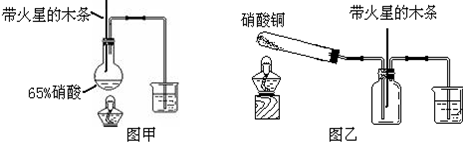

 气体时,木条复燃了,有的同学得出“NO2能支持木条的燃烧”的结论。你认为这一结论是否正确? (填“正确”或“不正确”),理由是____。
气体时,木条复燃了,有的同学得出“NO2能支持木条的燃烧”的结论。你认为这一结论是否正确? (填“正确”或“不正确”),理由是____。
